În martie am scris un articol în care am criticat argumentele aduse de Piersicuța împotriva vaccinării. Din cauză că au fost foarte multe lucruri de analizat am lăsat pe dinafară câteva, cel mai important fiind legat de siguranța vaccinurilor. Comentariile negative primite la acel articol au venit în special din partea persoanelor care au avut experiențe neplăcute cu vaccinurile, experiențe pe care nu le-am cenzurat (așa cum se întâmplă în tabăra anti-vaccin) și care cred că trebuie privite în context. Care e contextul? O comparație între efectele adverse ale vaccinurilor și cele ale bolii pentru care sunt făcute. Ce riscăm dacă ne vaccinăm și ce riscăm dacă nu ne vaccinăm. O să încerc să fac astfel de comparații în acest articol pentru ca persoanele îngrijorate să poată lua o decizie informată.
Să ne uităm la schema de vaccinare națională din România. Cea pentru anul 2015 am găsit-o aici (se aplică de la 1 aprilie) și conține următorul program:
| Vârsta recomandată | Tipul de vaccinare | Comentarii |
| Primele 24 ore
2-7 zile |
Vaccin hepatitic B (Hep B)
Vaccin de tip Calmette-Guérin (BCG) |
În maternitate |
| 2 luni | Vaccin hexavalent(DTPa-VPI-Hib-HepB)
Vaccin pneumococic conjugat |
Medicul de familie |
| 4 luni | Vaccin hexavalent(DTPa-VPI-Hib-HepB)
Vaccin pneumococic conjugat |
Medicul de familie |
| 11 luni | Vaccin hexavalent(DTPa-VPI-Hib-HepB)
Vaccin pneumococic conjugat |
Medicul de familie |
| 12 luni | Vaccin rujeolic-rubeolic-oreion(ROR) | Medicul de familie |
| 5 ani | Vaccin rujeolic-rubeolic-oreion(ROR) | Medicul de familie |
| 6 ani | Vaccin tetravalent diftero-tetano-pertussis acelular-poliomielitic (DTPa-VPI / VPI)
sau Vaccin poliomielitic inactivat (VPI) |
Medicul de familie |
| 14 ani | Vaccin diftero-tetanic / vaccin diftero-tetano-pertussis acelular (dT/DTPa) | Medicul de familie |
Varianta care a fost valabilă până în aprilie o puteți vedea la Direcția de Sănătate Publică a Județului Cluj aici. Programul pe 2013-2014 îl puteţi găsi aici. Dacă sunteți din Republica Moldova, puteți vedea programul de vaccinare între anii 2011 și 2015 aici. Diferențele cele mai importante sunt că în Republica Moldova încă se mai foloseşte vaccinul poliomielitic oral (VPO) și este obligatoriu și un vaccin contra infecției cu rotavirus (RV). În România, se folosește vaccinul poliomielitic inactivat (VPI), iar vaccinul RV este doar recomandat.
Propunerea mea este să le analizăm pe fiecare pe rând ca să vedem cât de eficiente sunt, împotriva a ce boli protejează, cât de periculoase sunt acele boli și ce efecte adverse au vaccinurile. Având toate aceste informații ne putem face o imagine mai clară despre riscuri și beneficii și putem lua o decizie mai bună. O să încerc în fiecare caz să mă folosesc de studii de calitate ridicată, adică recenzii sistematice, studii clinice randomizate, studii observaționale cu număr mare de participanți. O să evit studiile de caz, cele pe animale sau cele cu participanți puțini.
Să parcurgem vaccinurile în ordinea în care sunt făcute.
Notă: Am pus bookmark-uri spre referințe, dar văd că nu funcționează. Poate în următorul articol o să funcționeze.
Vaccinul Hep B (hepatita B)
Infectarea cu hepatita B este periculoasă, iar vaccinarea este una dintre cele mai bune metode pentru a evita problemele. Hepatita B este responsabilă pentru o treime dintre cazurile de ciroză, iar jumătate dintre cei cu ciroză fac carcinom hepatocelular (cancer la ficat). Se estimează că între 500.000 și 1,2 milioane de decese pe an în toată lumea sunt cauzate de hepatita B. Riscul de a face hepatita B cronică depinde de vârsta la care a avut loc infecția. De exemplu, copiii infectați în primul an de viață au un risc de 90%, cei infectați la vârsta de 1-5 ani au un risc de 25-50%, iar cei infectați după vârsta de 5 ani au un risc de 6-10%. Iar un sfert dintre cei care fac hepatită cronică fac cancer la ficat, un risc de 100-300 ori mai mare decât la cei neinfectați. În cazul copiilor mici infecția care duce la hepatită acută se manifestă asimptomatic în peste 90% din cazuri așa că este greu de detectat, însă după trecerea anilor riscul de a face hepatită acută crește la 33-50%. Printre simptomele hepatitei B acute sunt următoarele: febră, grețuri, vărsături, dureri abdominale, icter, hepatomegalie ș.a.1 Conform unei estimări a Organizației Mondiale a Sănătății, 650.000 oameni mor anual in cauza infecției cronice cu hepatita B, iar 130.000 din cauza infecției acute. Nu cred că este vreo persoană pentru care să fie indiferent faptul că face sau nu hepatită. Riscurile sunt foarte mari și, ca de obicei, e mai bine să prevenim decât să tratăm.2
Vorbind doar de România, 4,3% dintre cei care donează sânge prima dată sunt infectați cu hepatita B. E un procent foarte mare. Iar din toată populația țării, 1.203.922 de oameni sunt infectați. Uitați-vă în tabelul de la pagina 33 din acest raport ECDC și vedeți ce țară europeană are un număr mai mare de persoane cu hepatita B. Da, Turcia (cu o populație de 71 milioane). În rest, nimeni. Uitați-vă la pagina 8, sau la pagina 9. Ce țări sunt cu roșu? România e printre ele.
Pentru a preveni hepatita B există un vaccin (de fapt mai multe, în funcție de compania producătoare, dar sunt asemănătoare, așa că o să mă refer generic la vaccinul contra hepatitei B). După cum am văzut în schema de vaccinare, în România și în Republica Moldova acest vaccin se face în primele 24 ore de la naștere, iar doze ulterioare sunt incluse în vaccinuri polivalente. Decizia de a face primul vaccin atât de devreme este justificată de faptul că riscul de a face hepatita B este mai mare la copiii mici.
Eficiența vaccinului contra hepatitei B este în medie între 90 și 100%,3 cu ușoare variații geografice. Aceste valori au fost obținute din mai multe studii de lungă durată (fie ele observaționale sau studii clinice randomizate cu grup de control), în mai multe zone ale lumii. În general, în zonele cu mai multe boli eficiența a fost un pic mai scăzută, iar în țările mai dezvoltate a fost un pic mai ridicată. De exemplu, o recenzie sistematică din Iran a arătat că vaccinul oferă o protecție de 86,3%.4 Dacă ne uităm la eficiența programelor de vaccinare vedem rezultate asemănătoare. În țările în care hepatita era endemică la introducerea vaccinului, acesta a dus la o scădere masivă a infecțiilor. Un exemplu este Taiwan, unde în 15 ani programul de vaccinare a reușit să scadă infecțiile cu hepatita B la copii de la 9,8% la 0,7% (adică o scădere de aproximativ 93%). Mortalitatea cauzată de cancerul la ficat a scăzut și ea cu 60-70%. În Statele Unite (țară în care hepatita nu era endemică în 1990), programul de vaccinare a redus incidența hepatitei B la persoanele sub 20 ani de la 3/100.000 la 0,19/100.000 (adică o scădere de 94%), iar cazurile de hepatită acută au scăzut cu 75%. Aceste țări sunt doar două exemple, iar situația este asemănătoare în multe altele.5
Ciroza dată de hepatita A sau B este prevenită prin vaccinare.6 Mai mult, cazurile de cancer la ficat sunt reduse cu 78% prin vaccinare.7 Durata protecției oferite de vaccinul contra hepatitei B este de cel puțin 25 ani.8 Merită să menționez că pe lângă vaccinul intramuscular există și un vaccin intradermal care nu este chiar așa de bun și oferă o protecție cu 14% mai mică.9
Putem trece acum la siguranță. Vaccinul hepatic B este unul dintre cele mai sigure vaccinuri. S-au făcut multe studii de calitate înaltă și toate au arătat că este sigur.10
Efectele adverse comune sunt febră, durere și înroșire a locului injecției. Singurul efect advers sever apare foarte rar și este reprezentat de o reacție alergică. Din fericire nu s-a înregistrat niciun deces și niciun efect de durată în urma vreunei reacții alergice, dar nu sunt deloc plăcute. Ele apar doar la persoanele cu sensibilitate la drojdie pentru că pentru producerea vaccinului hepatic B sunt folosite celule de drojdie. Cele mai multe astfel de reacții se manifestă la persoanele între 10 și 64 ani, așa că există mari șanse ca acestea să știe că au o alergie, să spună medicului și astfel să nu facă vaccinul.11 Cum am zis, aceste reacții sunt rare. Medline Plus spune că există un caz la 1,1 milioane de vaccinări.
Dacă ați intrat pe vreun sait sau blog anti-vaccin probabil că ați citit despre riscul de scleroză multiplă și alte probleme neurologice, de diabet, de sindromul morții subite a sugarului sau de sindromul Guillain-Barré. Și probabil că v-ați pus problema dacă nu cumva acestea sunt produse de vaccinuri. Și eu mi-am pus problema și răspunul la care am ajuns este nu. Nu este nici măcar un risc mic de un caz la 100.000 sau un caz la un milion. Este risc zero. Vaccinul hepatic B pur-și-simplu nu produce astfel de boli. Și știm asta datorită unor studii foarte mari – cu milioane de participanți – și datorită unor meta-analize care combină mai multe studii mai mici. De exemplu, într-o recenzie sistematică din 2011 au fost analizate toate studiile făcute din anii ’60 și până la momentul curent (2011) care au verificat dacă există veo legătură între mai multe vaccinuri și scleroza multiplă. Rezultatul obținut este că nu există nicio legătură de cauzalitate.12 Cu alte cuvinte, cazurile de scleroză multiplă au apărut în același număr și la cei vaccinați și la cei nevaccinați. Alt studiu arată că deși au fost administrate până în prezent peste un miliard de doze de vaccin hepatitic B, nu se observă nicio creștere semnificativă a numărului de cazuri de scleroză multiplă, oboseală cronică sau SMSS (sindromul morții subite a sugarului).13
Un alt studiu s-a uitat la datele dintre 1991 și 1998 din SUA și a descoperit că au fost făcute 86 milioane de vaccinuri pentru hepatita B și au fost înregistrate 12 cazuri de SMSS (iar decesele indiferent de cauză au fost în număr de 18).14 Aceste 12 cazuri nu au fost produse de vaccin, ci au fost întâmplătoare (pentru că sindromul morții subite apare și cu, și fără vaccin). Iar dacă vaccinurile ar fi crescut numărul de SMSS, ar fi trebuit să vedem asta, dar în schimb vedem o scădere a numărului de SMSS din 1990 până în 2013 de la 22.000 la 15.000 (la nivel global).15 Și chiar și dacă cele 12 cazuri ar fi fost produse de vaccin, am avea un risc de 0,13 la milion. Așadar, vaccinul hepatic B nu produce sindromul morții subite la sugari.
În ce privește sindromul Guillain-Barré, un studiu a analizat 33 milioane de ani-persoană și a găsit 415 cazuri, dintre care doar 25 au apărut după vaccin, iar dintre astea, doar unul a fost după vaccinul hepatic B.16 Numărul de ani-persoană este produsul dintre numărul de persoane și numărul de ani în care au fost studiate (de exemplu, ar fi putut fi 1 milion de persoane studiate timp de 33 ani, dar în realitate nu toate persoanele au fost studiate același număr de ani pentru că informațiile au fost luate din mai multe studii, motiv pentru care se folosește această măsură: ani-persoană). Nici aici nu este vreo legătură cauzală, dar chiar dacă ar fi, riscul este atât de mic încât nici nu merită luat în considerare. Vaccinul hepatic B nu produce sindrom Guillain-Barré.
Oare cum reușesc să ne sperie cei care sunt împotriva vaccinurilor? Dacă ne gândim că a fost un caz de sindrom Guillain-Barré care a apărut după vaccinarea contra hepatitei B și probabil există un studiu de caz publicat pe undeva care descrie exact acest eveniment, e ușor pentru cineva să prezinte acel studiu și să spună: Uite, oamenii fac acest sindrom în urma vaccinului! E ușor să trecem cu vederea celelalte 33 milioane de cazuri în care nu s-a întâmplat nimic de acest fel pentru că acele cazuri nu sunt publicate individual niciunde. De asemenea, e ușor pentru cineva să prezinte câteva cazuri în care moartea subită a apărut după un vaccin și să „uite” să prezinte cazurile în care moartea subită a apărut fără să fie făcut vreun vaccin sau când în urma vaccinului n-a apărut moartea subită. Dând o greutate mare studiilor de caz care confirmă ceea ce credem deja (sau vrem să credem) ajungem la concluzii greșite, iar concluziile greșite nu sunt inofensive pentru că vorbim de boli care ar fi putut fi prevenite.
M-am gândit să fac și niște grafice pentru cei ce n-au timp să citească, dar mi se pare greu pentru că beneficiile vaccinului sunt la alt ordin de mărime decât efectele adverse și nu prea se vede nimic. Am făcut totuși două încercări. În prima este o comparație între incidența hepatitei B în Taiwan (o țară în care hepatita a fost endemică înainte de vaccinare) și reacțiile alergice. În a doua este o comparație între incidența hepatitei B în SUA (o țară în care hepatita nu era endemică) și reacțiile alergice. De reținut că vaccinarea a redus în ambele țări incidența cu peste 90%, iar hepatita produce efecte negative de lungă durată și chiar moartea, în timp ce reacțiile alergice sunt temporare și nu a fost înregistrat niciun deces legat de vaccinarea contra hepatitei B. Riscul de reacții alergice e atât de mic încât în prima imagine nici nu se vede.
Dacă ați trăi în Taiwan, ce ați alege: riscul din stânga (fără vaccin) sau cel din dreapta (cu vaccin)?
Dar dacă ați trăi în Statele Unite?
De la unul dintre cele mai sigure vaccinuri, trecem la unul mai controversat.
Vaccinul Calmette-Guérin (BCG) (tuberculoză)
Tuberculoza este o boală care a omorât 1,5 milioane de oameni în 2013 și a infectat 9 milioane. Cele mai multe decese au avut loc în țările subdezvoltate sau în curs de dezvoltare. Între 1990 și 2013 mortalitatea a înregistrat o scădere de 45%.17 Progresia bolii corelează cu vârsta infectării. Astfel, cei care se infectează înainte de vârsta de 12 luni au un risc de 50% de a face boala; cei infectați între 1 și 2 ani au un risc de 20-30%; cei infectați între 3 și 5 ani au un risc de 5%; cei infectați între 5 și 10 ani au un risc de 2%; iar cei infectați după vârsta de 10 ani au un risc de 5%. Copiii care fac tuberculoză fac forme mai severe decât adulții, iar persoanele infectate cu HIV sunt de 20 ori mai vulnerabile. Și la persoanele malnutrite există un risc mai mare de apariție a bolii.18 O problemă care devine tot mai importană este și tuberculoza rezistentă la tratament.19
În România cea mai mică valoare a mortalității a fost înregistrată în 1980 (doar 830 decese), după care a stagnat câțiva ani, iar din 1985 a fost în continuă creștere în jur de zece ani. În 1995 au fost înregistrate 2560 decese din cauza tuberculozei. Din 1997 a fost implementat un program de control (sub asistența OMS) care a reușit să reducă mortalitatea la 1482 decese în 2010. În 2007 mortalitatea a fost de 7,6 la 100.000. Chiar și așa, mortalitatea produsă de tuberculoză în România este de 6,6 ori mai mare decât în UE.20 În 2012 numărul celor care se aflau sub tratament pentru tuberculoză era în România de aproximativ 90 la 100.000, iar în Moldova de aproximativ 150 la 100.000.21 Tratamentul contra tuberculozei este lung (6-9 luni) și neplăcut (efectele adverse includ grețuri, vărăsturi, icter, febră), iar dacă nu este dus până la capăt există riscul ca boala să revină mai puternic (Mayo Clinic).
Pentru prevenire există un singur vaccin: BCG. Se încearcă producerea altor vaccinuri, mai bune, dar în prezent este singurul folosit. Cum am spus și în articolul despre Piersicuța, eficiența BCG-ului variază geografic, studiile arată că în India sau Malawi nu este deloc eficient contra tuberculozei (deși ajută contra leprei). Mai multe recenzii sitematice au arătat că eficiența este în medie de 50%, decesele sunt reduse cu 70%, protecția împotriva tuberculozei meningeale și miliare este de 75-86%, protecția contra pneumoniei este de 40%, contra bolilor febrile de 18%, iar efectul protectiv durează cel puțin 15 ani.22 Unele studii au găsit o durată a protecției de până la 60 ani în Alaska (la o eficiență de 52%),23 dar astfel de rezultate nu pot fi generalizate la fel cum nici cele din Malawi nu pot fi. În general se consideră că un singur vaccin BCG este suficient, iar al doilea nu oferă nicio protecție în plus.24 În România se face unul singur, în Moldova se fac două.
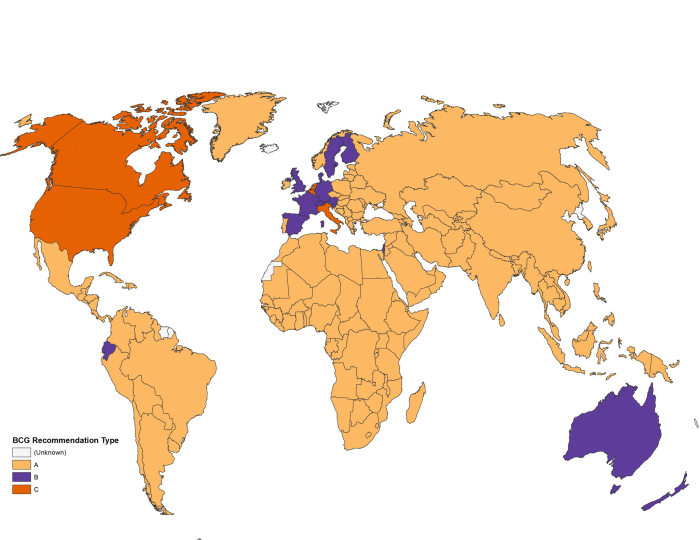
Vaccinarea cu BCG este foarte eficientă din punct de vedere al costurilor la nivel mondial, în special pentru că reduce apariția tuberculozei meningeale și a tuberculozei miliare.25 Această eficiență este mare în special în țările în care tuberculoza este endemică. În Franța sau în Olanda, de exemplu, sunt vaccinați doar cei considerați la risc (în special emigranții). Statele Unite sunt un alt exemplu în care nu se folosește vaccinul BCG la nivel național. Una dintre probleme este că după un vaccin BCG, testul de piele pentru detectarea tuberculozei nu mai este așa de eficient, iar țările dezvoltate preferă să identifice persoanele cu infecție latentă și să administreze tratament înainte ca boala să progreseze.26
Să trecem la efectele adverse. Nu doar eficiența, ci și efectele adverse variază în funcție de mai mulți factori. Unul dintre aceștia este tulpina folosită în vaccin.
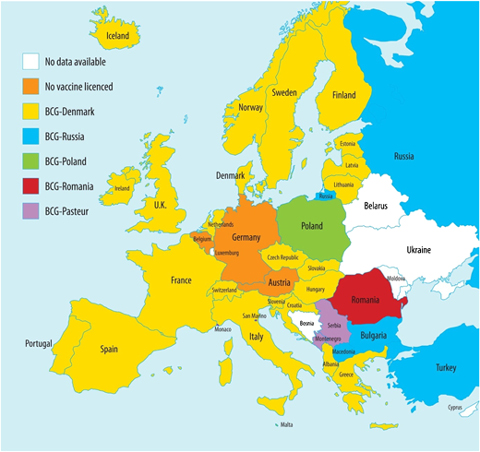
În România se folosea o tulpină românească și cred că se folosește și în prezent (vezi ANM), iar în anumite situații a fost importată tulpina din Danemarca. În Republica Moldova se folosește tulpina rusească (vezi AMDM). Sunt șanse să greșesc, nu mi-e prea clar dacă informațiile de pe saiturile agențiilor de medicamente sunt actualizate. În plus, mai sunt și problemele cu Institutul Cantacuzino.
Din cauză că există atâtea tulpini, iar efectele adverse variază în funcție de tulpini, e greu de evaluat exact care sunt efectele din România și Moldova. În plus, mai sunt și alți factori care influențează efectele adverse. Cel mai important este sistemul imunitar. Este cunoscut că persoanele infectate cu HIV sau cu alte probleme de imunitate au reacții adverse mult mai frecvente în urma vaccinului BCG, motiv pentru care OMS recomandă ca acestea să nu fie vaccinate, iar de multe ori efectele adverse raportate nu sunt separate între cei cu sistem imnitar funcțional și cei imunodeprimați/imunosuprimați.27
Dacă ne luăm după OMS și CDC, riscurile de reacții adverse severe sunt următoarele.28
Reacții adverse severe: reacții la locul injecției (printre care abcese subcutanate și cicatrici); leziuni cutanate distincte de locul injecției (șancră, lupus vulgarie, scrofulodermă, tuberculide papulo-necrotice) (între 1/1.000 și 1/10.000 cazuri), limfadenite (ganglioni aderenți la piele cu sau fără supurație) (387 cazuri pe milion la cei sub un an, și 25 cazuri pe milion la cei peste 1 an), leziuni musco-scheletale (între 0,39 și 0,89 cazuri pe milion), limfadenită multiplă și leziuni diseminate nefatale (0,39 pe milion) și fatale (0,19-1,56 la milion, în special la cei imunocompromiși).
Reacții adverse sistemice: osteite și osteomielite (variază între 0,01 cazuri pe milion în Japonia și 43,4 cazuri pe milion în Finlanda; în ultima vreme au devenit mai rare), boală BCG diseminată (1,56-4,29 cazuri pe milion la cei fără HIV și până la 1% la cei cu HIV), immune reconstitution inflamatory syndrome (efect rar la persoanele cu HIV).
În Polonia rata efectelor adverse este de 0,2-0,6 la mie, iar complicațiile serioase apar la un caz dintr-un milion de vaccinuri BCG.29
De menționat că limfadenita fără supurație este în general benignă și trece în câteva săptămâni sau luni, dar în cazul în care apare supurația e nevoie de tratament.30 În afara efectelor adverse de mai sus (și a celor ușoare, pe care nu le-am mai menționat), vaccinul BCG a fost investigat și în legătură cu altele. De exemplu, nu este asociat cu astm sau cu scleroză multiplă.31
În concluzie, știm că vaccinul BCG este benefic în multe zone în care tuberculoza este endemică (beneficiile sunt mai mari decât costurile) și că nu este folosit decât selectiv în țări dezvolate (SUA, Franța etc.). În 2012, România a oprit temporar vaccinarea BCG din cauza unor efecte adverse, însă OMS a recomandat reluarea vaccinării pentru că tuberculoza încă este o problemă în țara noastră. Care este numărul de cazuri de tuberculoză sub care vaccinarea nu mai este necesară? Răspunsul este prea complicat ca să îl dau eu (sau Olivia Steer). Discuțiile trebuie purtate de medici. Dacă datele arată că se poate renunța la BCG, atunci o fie înlocuit cu testare atentă a posibilelor infecții și tratarea lor cât mai repede. Simpla renunțare la BCG nu este însă o opțiune.
O abordare interesantă puteți citi într-un articol din revista Viața Medicală: Vaccinarea BCG – între mit și realitate.
Vaccinul pneumococic conjugat
Pneumococii produc mai multe boli și simptome.32
Pneumonia este cea mai comună dintre cele grave, iar simptomele ei includ febră și frisoane, tuse, probleme cu respirația, dureri în piept. Complicațiile includ pleurităpar, pleurezie, empiem, bacteremie (apare la peste un sfert din cei bolnavi și poate produce endocardită sau meningită, iar cei care nu mai au splină mor în cele mai multe cazuri), fibroză pulmonară (apare rar) sau abces pulmonar (foarte rar). În jur de 5% dintre cei cu pneumonie produsă de pneumococi mor (iar pericolul este și mai mare în cazul celor bătrâni). Meningita se manifestă prin gât înțepenit, febră, dureri de cap, durere de la lumină puternică. Dintre cei cu vârsta sub 5 ani care fac meningită, 10% mor, iar cei ce supraviețuiesc pot avea probleme pe termen lung. Bacteremia este o infecție a sângelui și se manifestă prin febră, frisoane ș.a., iar complicațiile pot duce la moarte la 40% dintre copii. Jumătate dintre infecțiile urechii mijlocii sunt produse de pneumococi.
Conform unei estimări OMS, în anul 2000 au avut loc 14,5 milioane de episoade de boală pneumococică severă în toată lumea și au fost 826.000 decese la copiii între 1 și 59 luni.33
Pentru prevenirea infecțiilor și a bolilor produse de pneumococi se folosesc vaccinuri. Ajungem astfel la partea în care ne întrebăm cât de eficiente sunt. Pentru a afla avem la dispoziție mai multe recenzii sistematice de la Colaborarea Cochrane (care adună toate datele de la studii clinice) și mai multe studii observaționale care compară situația celor vaccinați cu situația celor nevaccinați (urmărind, de exemplu, ce s-a întâmplat cu numărul de spitalizări cauzate de infecțiile cu pneumococi înainte și după introducerea vaccinurilor).
O recenzie Cochrane din 2009 care a evaluat cât de eficiente sunt vaccinurile pneumococice conjugate pentru a preveni bolile pneumococice a avut la dispoziție datele de la mai multe studii clinice randomizate care în total au avut 57.015 copii care au primit vaccinul pneumococic și 56.029 care au primit placebo sau un alt vaccin. În urma analizei a aflat că vaccinul pneumococic conjugat are o eficiență de 80% contra serotipurilor incluse în vaccin și de 58% contra tuturor bolilor peumococice indiferent de serotip.34 O altă recenzie, tot de la Cochrane, din 2013 a ajuns la rezultate asemănătoare, concluzionând că vaccinurile împotriva pneumococilor sunt eficiente pentru a preveni bolile pneumococice. De asemenea, a mai descoperit că în cazul celor cu boli cronice datele nu sunt așa de clare nici în ce privește eficiența în general, nici pentru prevenirea pneumoniei sau a mortalității.35 Așa că din păcate nu știm sigur dacă cei cu boli cronice au beneficii de la acest vaccin. Mai este și o recenzie care a încercat să afle dacă vaccinurile pneumococice sunt utile contra otitei medii (indiferent de cauza ei) și a descoperit că în general nu sunt foarte utile. Totuși, dacă au fost luate în considerare doar otitele produse de pneumococi, eficiența a fost de 50%. Însă otita medie apare din multe cauze și prin urmare folosirea vaccinului pneumococic strict pentru prevenirea otitei nu este utilă.36 Este însă utilă pentru bolile produse de pneumococi, adică pentru bolile pentru care a fost făcut.
Dar astea nu sunt toate dovezile pe care le avem. Poate cele mai importante sunt cele din teren, cele care arată cât de mult a scăzut numărul de spitalizări după introducerea vaccinului.
Să luăm ca exemplu Danemarca. În 2007 a fost introdus vaccinul contra pneumococilor în programul național. Ce efect a avut? Un studiu a comparat perioada 2000-2007 (înainte de vaccin) cu perioada 2008-2010 (după vaccin) și a observat că pentru copiii mai mici de 5 ani incidența bolilor produse de pneumococi a scăzut de la 26,7/100.000 la 16,3/100.000, iar mortalitatea produsă de pneumococi a scăzut de la 1,8% la 0%. A avut de beneficiat și populația generală (care n-a primit vaccinul) datorită efectului de grup, dar bineînțeles nu atât de mult.37 Pneumococii sunt de mai multe tipuri, iar în vaccinuri sunt incluse doar anumite serotipuri (în PCV-7 sunt 7, în PCV-13 sunt 13 etc.). În general, incidența infecțiilor produse de serotipurile incluse scade foarte mult, în timp ce incidența celorlalte crește un pic. În acest caz, a crescut de la 11,8/100.000 la 13,9/100.000. Putem face astfel o comparație brută: infecțiile cu serotipuri incluse în vaccin au scăzut cu 10,4 la 100.000, iar cele cu serotipuri neincluse au crescut cu 2,1/100.000. Luate împreună se observă un beneficiu clar al introducerii vaccinului.
Să luăm un alt exemplu: Australia.38 Aici a fost un succes și mai mare. La toți copiii sub doi ani din sudul Australiei (despre sudul Australiei a fost vorba în studiu) care au fost vaccinați a fost observată o scădere de 81% a incidenței bolilor produse de pneumococi, indiferent de serotip (și de 98% pentru serotipurile incluse în vaccin). Chiar și la cei nevaccinați a fost observat un efect benefic. De exemplu, pentru cei peste 65 ani a fost observată o reducere cu 27% pentru toate serotipurile – un efect de grup foarte mare. Ca de obicei, incidența serotipurilor neincluse în vaccin a crescut puțin, motiv pentru care e nevoie de precauție pe viitor (înlocuirea serotipurilor pentru a se potrivi mai bine), dar în prezent rezultatele sunt foarte bune.
Rezultatele sunt asemănătoare peste tot unde a fost introdusă vaccinarea împotriva pneumococilor. Dacă mai vreți două exemple, încercați Statele Unite și Africa de Sud.39
O posibilă problemă a vaccinării este efectul asupra celor prea mici să fie vaccinați (în general cei mai mici de 90 zile). S-a pus problema că schimbarea serotipurilor produsă de vaccin ar putea avea efecte negative asupra celor nevaccinați. Din fericire, mai multe studii făcute în mai multe țări arată că în cel mai rău caz rata de infecție nu se schimbă (scade infecția cu serotipuri incluse în vaccin, dar crește la fel de mult rata infecțiilor cu serotipuri neincluse), iar în cel mai bun caz (cum e, de exemplu, Marea Britanie) apare un efect protector (infecțiile cu serotipuri incluse sunt mult mai puține, iar cele cu serotipuri neincluse în vaccin sunt doar un pic mai multe decât anterior și nu compensează negativ).40 Deci niciun motiv de îngrijorare.
Cum rămâne însă cu efectele adverse? Urmărind datele ce țin de spitalizări în primi 5 ani de la introducerea vaccinului în Australia s-a observat o creștere a numărului de cazuri de empiem (puroi).41 Acesta este produs de serotipuri care nu sunt incluse în vaccin. Pentru comparație, numărul de spitalizări pentru pneumonie a scăzut cu 15.304, iar pentru empiem a crescut cu 83. Alte diferențe legate de vaccin nu au fost observate în numărul de spitalizări.
Efectele adverse ale vaccinurilor contra pneumococilor au fost evaluate în cel puțin un studiu post-marketing (companiile producătoare sunt obligate să facă astfel de studii) și în cel puțin două recenzii sistematice. Au fost observate următoarele:42
Efecte adverse locale (ușoare sau moderate): iritare locală a pielii (47%-72%), umflături (21%-27%), indurații (19%-21%), înroșire a pielii (26%-35%).
Efecte adverse sistemice: iritabilitate (68%-71%), somnolență (57%-79%), febră (24%), apetit scăzut (54%), urticarie (2%).
Alte efecte adverse: au fost înregistrate 13,7 cazuri de convulsii febrile la 100.000 vaccinări (convulsiile febrile deși sunt înspăimântătoare, nu sunt periculoase și nu au niciun efect negativ pe termen lung; vezi Medline Plus). Efecte adverse severe sau decese n-au fost observate.
Eficiența plus lipsa efectelor adverse serioase reprezintă un motiv foarte bun pentru ca vaccinul pneumococic conjugat să fie inclus în schemele de vaccinare națională din toată lumea. E și motivul pentru care e recomandat de OMS încă din 2007.43
Vaccinul DTP (difterie-tetanos-tuse convulsivă)
Difteria este o boală acută produsă de bacteria C. diphtheriae. Se transmite prin contact direct, strănuturi sau tuse. Complicațiile acestei boli includ moarte, miocardită, neurită, otită, insuficiență respiratorie ș.a. Rata mortalității în cazul celor bolnavi este de 5-10% în general și mai mare (chiar și 20%) în cazul celor sub 5 ani sau peste 30-40 ani și nu s-a schimbat foarte mult în ultimii 50 ani.44 De exemplu, un studiu din 1954 în care au fost incluși 1.433 bolnavi de difterie a găsit o mortalitate de 9,6%.45 Ce a scăzut, în schimb, este incidența. Mai puțini oameni se îmbolnăvesc. Doar din 2000 până în 2009 incidența a scăzut cu mai mult de 95% în Europa.46 Alte complicații includ miocardită (apare la 6% dintre cei cu difterie, iar dintre aceștia, între 10 și 25% au disfuncții cardiace severe), neuropatie (rară la cei cu forme ușoare ale bolii, dar prezentă la 75% dintre cei cu forme severe), hipotensiune, pneumonie, insuficiență renală (de asemenea comune la cei cu forme severe ale bolii), encefalită, infarct cerebral (rare, dar posibile).47
Tetanosul este o boală cu o incidență mică, dar este foarte periculoasă și poate fi prevenită prin vaccinare. Din 1972 până în 2001, în SUA doar 16% dintre cei care au avut tetanos aveau 3 vaccinuri făcute (dar nu se știe dacă recent sau nu). Dintre cei care au murit, doar 0,19% aveau trei doze făcute, în timp ce 28% nu aveau niciuna.48 Pe lângă tetanosul la adulți, mai există un risc și pentru nou-născuți. Acesta apare în general în situațiile în care cordonul ombilical e tăiat cu un obiect care nu este suficient de steril. În țările dezvoltate aceste evenimente sunt foarte rare, dar dacă apar sunt foarte grave: fără tratament, mortalitatea e de 100%, iar cu tratament variază între 10 și 60%.49
Tusea convulsivă produce probleme serioase. Dintre copiii sub un an care fac tuse convulsivă, jumătate ajung la spital. Dintre aceștia: 23% fac pneumonie, 1,6% au convulsii violente, 67% au apnee, 0,4% fac encefalopatie, iar 1,6% mor (CDC). În cazul adulților, doar 5% sunt spitalizați. Complicațiile includ sângerări (nas și ochi), coaste învinețite, hernie, față umflată, ulcerații ale gurii și limbii, infecții ale urechii (NHS), ataxie, convulsii, orbire, surzenie, sincope. Aceste complicații apar mai des la copiii sub 12 luni.50
Pentru prevenirea acestor trei boli există un vaccin comun: DTP. Și ca să nu fie totul simplu, există mai multe variante: DTwP (numit uneori doar DTP), DTaP, Tdap, dT, Td. Diferența dintre DTwP și DTaP (sau dTPa în România) este că DTwP conține componenta celulară pentru tusea convulsivă (whole-cell, adică o celulă inactivată a bacteriei), iar DTaP conține componenta acelulară (acellular, adică doar proteine ale bacteriei). Primul este mai vechi și mai eficient, dar cu mai multe efecte secundare, iar al doilea este mai nou, nu chiar atât de eficient, dar cu mai puține efecte secundare. Țările dezvoltate folosesc în general vaccinul acelular. Tdap este același vaccin, dar folosit pentru adulți în unele țări (în SUA, nu în România din câte știu, cel puțin nu în schema națională). dT și Td sunt vaccinuri care conțin doar componentele difterie și tetanos. În general o literă mică indică o concentrație mai mică a acelei componente, iar o literă mare o concentrație mai mare.
Prin anii ’70 incidența tusei convulsive a fost redusă atât de mult încât s-a pus problema efectelor adverse ale vaccinului (wP). Unele țări au renunțat la programul de vaccinare, iar altele au așteptat dezvoltarea unui vaccin mai sigur (aP). Suedia, de exemplu, a oprit vaccinarea cu wP în 1979 și imediat incidența tusei convulsive a început să crească. În 1985 ajunsese deja la 3,2% din populație.51 Încă din anii ’70 a fost căutată o soluție, iar în anii ’80 au fost făcute 60 milioane de doze de DTaP în Japonia. Datorită succesului acestor vaccinări, în anii ’90 au fost făcute studii clinice și vaccinul DTaP a primit licența.52
În ce privește eficiența, vaccinurile DTwP știm că sunt mai bune decât cele DTaP,53 dar cât de bune sunt cele DTaP? Cel mai bine putem afla asta dintr-o recenzie sistematică foarte recentă (2014) făcută de Colaborarea Cochrane care a inclus 46,283 participanți în studii clinice dublu-oarbe, randomizate.54 Eficiența obținută este de 84-85% în prevenirea tusei convulsive pentru vaccinul cu trei componente. O altă recenzie, ce a inclus 500.000 participanți din Danemarca, a găsit o eficiență de 71% în prevenirea infecției și de 93% în prevenirea spitalizărilor din cauza tusei convulsive.55 Această diferență între infecții și spitalizări se potrivește cu ceea ce s-a observat și în alte studii, și anume că persoanele vaccinate care totuși fac tuse convulsivă, fac o variantă mult mai ușoară care de cele mai multe ori trece fără spitalizare.56 Dacă sunteți interesați și de Tdap, un studiu de tip caz-control a găsit o eficiență între 54 și 64% în prevenirea infecției.57 În general, Tdap este folosit ca booster.
În cazul difteriei, studii caz-control din anii ’90 au arătat că pentru copiii sub 15 ani eficiența vaccinului e de 95,5% la trei doze și 98,4% la 5 doze.58
Vaccinul contra tetanosului, din câte știu, nu a fost testat individual în studii clinice randomizate, așa că eficiența sa trebuie estimată din nivelurile de antitoxine din sânge și din câte cazuri de infecție cu tetanos au avut loc în cazul celor vaccinați. Pentru că nivelurile de antitoxine sunt mari timp de cel puțin 10 ani după vaccin, iar cazurile de tetanos sunt aproape inexistente la cei vaccinați, eficiența este estimată la 100%.59 Iar în ce privește reducerea incidenței tetanosului la nou-născuți, o recenzie sistematică de la Colaborarea Cochrane a arătat că dacă mamele sunt imunizate în perioada anterioară nașterii, riscul ca nou-născuții să moară din cauza tetanosului scade cu 94%.60
Efectele adverse. Existența mai multor vaccinuri complică un pic situația, dar pentru că în prezent cel mai folosit este DTaP, o să ne concentrăm pe acesta. Este cunoscut că efectele sale secundare sunt mai puține și mai ușoare decât cele ale vaccinului DTwP.61 De asemenea, în mod surprinzător, vaccinurile cu adjuvanți produc mai puține efecte adverse decât cele fără sau cu o concentrație mai mică. De exemplu, o recenzie sistematică din 2004 a arătat că vaccinurile DTP cu adjuvanți pe bază de aluminiu au crescut riscul de înroșire și umflare a pielii la locul injecției, dar au redus riscul de alte reacții în general. Riscul de convulsii sau plânsete persistente nu au fost diferite; reacții adverse de lungă durată nu au fost observate în niciun caz.62
În ce privește problemele neurologice, risc mai mare de convulsii (din cauza febrei) a fost observat la vaccinurile DTwP comparativ cu cei nevaccinați, iar la cele DTaP a fost observat un risc mult mai mic. Riscul de encefalopatie și de epilepsie este același și pentru cei vaccinați și pentru cei nevaccinați.63 Riscul de scleroză multiplă este mai mic pentru cei vaccinați contra difteriei și tetanosului.64 De asemenea, nu a fost găsită vreo legătură nici între vaccinul DTaP și alte probleme neurologice, precum autism, ataxie, encefalomielită acută, neurită optică, sindrom Guillain-Barré, Bell’s Palsy ș.a.65
Nu crește nici riscul de diabet zaharat, purpură trombocitopenică, fibromialgie, miocardită,65 artrită reumatoidă.66 Riscul de moarte subită a sugarului (SIDS) este mai scăzut la cei vaccinați.67 Riscul de boli atopice pare să fie mai mic după vaccinarea cu DTwP (dar nu și după DTaP),68 iar riscul de anafilaxie/reacții alergice pare să fie mai mare după vaccinarea cu DTaP. Au fost raportate doar câteva cazuri (niciunul cu o vârstă sub 12 ani) în Statele Unite, toate au avut loc la câteva minute după vaccin și toate au fost tratate fără probleme.69 Așa că riscul de reacții alergice este extrem de mic.
Conform CDC, reacțiile adverse care pot să apară după vaccinul DTaP includ următoarele. Reacții ușoare: febră (1 din 4), umflături și înroșiri ale locului injecției (1 din 4), usturime a locului injecției (1 din 4), oboseală, lipsa poftei de mâncare (1 din 10), vărsături (1 din 50); Reacții moderate: convulsii (1 la 14.000), plânsete persistente (1 la 1.000), febră mare (1 la 16.000). În ce privește reacțiile severe, acestea sunt atât de rare (mai puțin de 1 la un milion) încât nu s-a stabilit că ar fi produse de vaccin, dar CDC le menționează (convulsii de lungă durată, comă, vătămări neurologice permanente). Studii mari nu au găsit astfel de asocieri.70
Ar mai fi câteva lucruri de zis. Un studiu observațional recent din Marea Britanie a fost făcut pentru a se vedea dacă vaccinurile contra tusei convulsive sunt sigure în cazul femeilor însărcinate și a descoperit că sunt.71 Un alt studiu a descoperit că reacțiile locale pot fi reduse dacă vaccinul DTaP este făcut în coapsă, în cazul copiilor între 1 și 6 ani.72 Iar un alt studiu a descoperit că refuzul părinților de a vaccina duce la un risc mai mare de tuse convulsivă.73
Vaccinul VPI/VPO (poliomielită)
Poliomielita este o boală aproape de a fi eradicată datorită vaccinurilor. Dar încă mai există și pentru a o eradica trebuie continuate programele de vaccinare. Ca să înțelegem de ce este important să o eradicăm, trebuie să vedem cum se manifestă.
În aproximativ 95% din cazuri este asimptomatică (sau are simptome asemănătoare gripei), dar celelalte cazuri sunt cele grave. Simptomele includ: febră, oboseală, dureri de cap, de mâini și de picioare (uneori groaznice, în special la adulți), vărsături, constipație, gât înțepenit etc. Cel mai des se manifestă la copiii sub 5 ani. Din cei infectați cu virusul poliomielitei, 1 din 200 o să aibă probleme musculare și deficiențe în a se mișca (paralizie temporară). Dintre aceștia, 2-5% dintre copii și 15-30% dintre adulți mor. Cea mai comună cauză a mortalității este paralizia bulbară (bolnavii nu mai pot respira și se sufocă), dar există și alți factori care contribuie la mortalitate: hipertensiunea, hipotensiunea, colapsul circulator, disfuncția autonomă etc. Altă problemă este meningita aseptică neparalitică (apare la 1-2% dintre cei cu poliomielită și de obicei trece în câteva zile sau săptămâni). Cea mai cunoscută problemă este paralizia. Între 0,1 și 1% dintre toți cei infectați cu virusul poliomielitei paralizează permanent. Iar dacă paralizia are loc în copilărie, poate afecta și creșterea, de exemplu un picior se dezvoltă normal, dar celălalt rămâne mai mic.74
Poliomielita este groaznică și nu are tratament. Pot fi tratate anumite simptome, ceea ce se și întâmpla înainte de descoperirea vaccinurilor și astfel a fost redusă mortalitatea, dar odată infectată, o persoană nu poate decât să spere că nu o să fie printre cei care mor sau paralizează. Tocmai de aceea prevenirea este crucială.
Există două tipuri de vaccinuri: VPI și VPO (sau în engleză IPV și OPV). VPI conține virus inactivat, are mai puține efecte secundare, a fost produs de Jonas Salk, este mai scump și este folosit mai mult în țările dezvoltate. România a trecut de la VPO la VPI în 2008-2009.75 În Republica Moldova încă se folosește VPO, un vaccin ce conține virus viu atenuat, este mai eficient, dar are unele dezavantaje cum ar fi eliminarea virusului de către persoanele vaccinate sau cazurile de paralizie asociată cu vaccinul.
Înainte să trecem la efectele adverse, să vedem cât de eficiente sunt aceste vaccinuri. Pentru VPI, o recenzie sistematică din 2014 a concluzionat că protecția oferită împotriva infectării este de peste 80% pentru două doze de vaccin.76 O recenzie (de data asta nesistematică) estimează eficiența a trei doze de VPI la 99-100%.77 Nu se cunoaște însă foarte bine cât de mult durează protecția. Se știe că durează pentru câțiva ani, dar nu a fost studiat foarte mult acest lucru. Unele estimări ale eficienței se bazează pe valori surogate precum nivelul de anticorpi, însă există și studii care evaluează direct eficiența clinică, iar rezultatele sunt asemănătoare. De exemplu, un studiu clinic randomizat cu grup de control a găsit că o doză de VPI are o eficiență de 36%, iar două doze au o eficiență de 89%. Și să nu uităm de primul studiu ce a evaluat vaccinul: făcut în anii ’50, a fost unul dintre cele mai mari studii clinice din istorie, cu 600.000 participanți care au primit vaccinul și peste un milion în grupul de control. Eficiența obținută atunci a fost de 80-90% contra poliomielitei paralitice.78 Ar mai fi de spus și că unele studii evaluează eficiența contra infecției cu poliovirus în general, iar altele evaluează eficiența pentru fiecare tip în parte (sunt trei în total). De exemplu, un alt studiu clinic a găsit că trei doze de VPI au o eficență de 94% contra virusului de tip I, 83% contra celui de tip II și 100% contra celui de tip III.79 În cazul VPO, o singură doză are o eficiență de 50%; două doze au o eficiență de 89-100% pentru virusul de tip II și de 99-100% pentru cele de tip I și III; iar trei doze au o eficiență de cel puțin 96%, indiferent de tipul virusului. Iar efectul durează cel mai probabil pe viață.80
Acestea sunt beneficiile. Să vedem și care sunt riscurile.
Vaccinurile VPI nu conțin adjuvanți, motiv pentru care sunt mai scumpe și nu sunt accesibile în țările slab dezvoltate. Odată cu progresul făcut pentru eradicarea poliomielitei, tot mai multe țări au trecut de la VPO la VPI și este important să înțelegem de ce este făcută această schimbare. Vaccinul VPO conține virus viu atenuat care este eliminat în fecalele celor vaccinați. Fiind viu, prezintă un risc pentru cei nevaccinați, condiție cunoscută ca cVDPV (circulating vaccine-derived poliovirus), situație ce apare dacă virusul din VPO este lăsat să se replice pentru mai mult de șase luni.81 Dacă vaccinarea are o acoperire mare, această problemă este redusă sau evitată. Totuși, ce facem după ce am eliminat poliomielita „sălbatică”? Soluția pe care au adoptat-o țările dezvoltate a fost trecerea la vaccinul VPI, care conține virus inactivat și prin urmare nu este periculos pentru nimeni.
Reacțiile adverse comune care pot apărea în urma vaccinului VPI sunt febră, iritabilitate, lipsa poftei de mâncare, oboseală; de asemenea, pot exista reacții la locul injecției (usturime, înroșire, durere). Unele persoane pot să aibă reacții alergice precum dificultate în respirație sau înghițire, urticarie, mâncărime, înroșirea pielii în jurul urechilor, inflamarea ochilor, nasului și a feței, stare de oboseală. Au fost observate și cazuri foarte rare de anafilaxie. Primirea vaccinului în copilărie crește, de asemenea, sensibilitatea la alergii mai târziu în viață.82 Ca să punem în context, e important să știm că reacțiile alergice, inclusiv anafilaxia, sunt produse de multe lucruri, printre care diverse mâncăruri (alune, crevete), medicamente (penicilină și alte antibiotice de tip β-lactam, opioide), înțepături de insecte, latex ș.a.83
Și vaccinul VPO este lipsit de reacții adverse severe, cu excepția uneia: PPAV (poliomielită paralitică asociată cu vaccinul). Riscul de PPAV este de 1 la 2,5 milioane de vaccinuri. Există variații în estimări. De exemplu, OMS dă valoarea de 1 caz la un milion, în timp ce alte valori sunt de 1 caz la 6,2 milioane sau 1 caz la 2,5 milioane de vaccinuri.84 Incidența PPAV la nivel mondial pe persoane (nu pe doze de vaccin) este în jurul valorii de 3,8 cazuri la 1 milion de născuți. Pentru că țările dezvoltate au trecut exclusiv la VPI, cazurile de PPAV sunt concentrate în țările mai puțin dezvoltate. Din acest motiv se plănuiește introducerea vaccinului VPI în toate țările, ceea ce va reduce complet cazurile de PPAV.85
În România, vaccinurile au reușit eliminarea poliomielitei. După introducerea vaccinurilor au fost două mici epidemii: una în 1980-1982 când a fost o problemă cu prepararea vaccinului și n-a fost disponibil, iar cealaltă în 1990-1992 într-o comunitate nevaccinată de romi. În anii ’90 în România au fost mai multe cazuri de PPAV decât în alte țări. Situația a fost investigată și s-a descoperit că dacă recipienții vaccinului VPO au primit mai multe injecții intramusculare cu antibiotice în următoarele 30 zile, riscul de PPAV era de 2 până la 10 ori mai mare. Riscul a fost scăzut prin evitarea acestor injecții intramusculare. În perioada 1995-2006 au fost mai puțin de 2 cazuri pe an de PPAV, iar în 2007 zero. Din 2008 s-a renunțat la VPO și de atunci se folosește VPI.86
Decizia de a trece de la VPO la VPI este legată și de factori politici și economici, nu doar de factori științifici pentru că VPO este mai ieftin, dar produce poliomielită paralitică în cazuri foarte rare. Chiar și așa rare cum sunt, e de dorit să fie evitate. Cum ziceam, Moldova încă folosește VPO, în timp ce România a trecut la VPI. Cred că este benefic să existe o discuție în legătură cu costurile și beneficiile unui vaccin comparativ cu ale celuilalt (merită să dăm mai mulţi bani pe vaccinul inactivat pentru a scăpa de cele câteva cazuri rare de PPAV?). Însă o discuție despre cum e mai bine, să vaccinăm sau nu, este destul de scurtă. În România înainte de introducerea vaccinurilor, cel puțin 1 din 10.000 oameni paraliza din cauza poliomielitei.87 Chiar și cu un risc de paralizie de 1/2,5 milioane de doze VPO, răspunsul este clar. Diferența este atât de mare încât riscul dat de vaccinul oral nici nu se vede pe grafic. Iar riscul dat de vaccinul inactivat este zero.
Vaccinul Hib (Haemophilus influenzae b)
Hib este o bacterie care produce mai multe boli, printe care: meningită, pneumonie, septicemie, pericardită, epiglotită, artrită septică, osteomielită (NHS). La nivel global o estimare din 2000 arată că înainte de vaccinare, în cazul copiilor sub 5 ani, incidența meningitei era de 57/100.000, iar incidența tuturor bolilor produse de Hib, în afară de pneumonie, era de 71/100.000 (dintre care 13% mor), iar dacă includem și pneumonia, incidența crește la 370/100.000. Însă în locurile cele mai afectate nu sunt ținute statistici despre incidență, motiv pentru care estimările pot fi mai mici decât realitatea.88 O estimare mai recentă, din 2009, arată că Hib a produs 8,13 milioane de cazuri de boli grave în toată lumea în 2000, dintre care 371.000 de decese.89
Mortalitatea variază. De exemplu, în India, dintre cei care fac meningită din cauza Hib, 20-29% mor, iar 30% rămân cu sechele neurologice permanente. În Kenya, mortalitatea e de 23% (pentru copiii sub 5 ani). În Africa, un sfert dintre cei care au făcut meningită au rămas cu sechele neurologice. În Statele Unite ale Americii, doar 3-6% dintre cazurile de infecție cu Hib sunt fatale, iar 20% dintre supraviețuitorii de meningită produsă de Hib au sechele neurologice.90 Un studiu care a urmărit pe o perioadă mai lungă oamenii care au supraviețuit după meningită, a descoperit următoarea situație: 7,8% au avut probleme de auz, 3% probleme de vedere, 20% probleme mentale și 25% probleme psihomotorii. În același timp, într-un grup de control doar 2% au avut probleme mentale și psihomotorii.91
Prin urmare, prevenirea infecției cu Hib este foarte importantă. Pentru a vedea cât de eficiente sunt vaccinurile avem două metode de a afla. Una este să ne uităm la studiile clinice randomizate, iar cealaltă este să ne uităm direct la efectul din teren. Putem face ambele lucruri pentru Hib.
Două recenzii sistematice arată că vaccinul este eficient. În numere, asta înseamnă o eficiență de 84% contra bolii invazive Hib, 75% contra meningitei și 69% contra pneumoniei.92 Realitatea din teren arată chiar mai bine. De exemplu, în Kenya înainte de introducerea vaccinului, 66 din 100.000 oameni aveau boală invazivă Hib, iar la trei ani după, incidența a scăzut la 7,6 din 100.000. Asta înseamnă o eficiență de 88%. Să ne uităm și la o regiune dezvoltată. În țările scandinave incidența infecțiilor cu Hib înainte de vaccin era de 49/100.000 (pentru copiii sub 4 ani), iar după a scăzut cu 95%.93 Iar dacă o să căutați studii despre alte țări o să găsiți rezultate asemănătoare.
Să vedem acum și efectele adverse. Datele furnizate de două meta-analize ne arată că reacțiile adverse sunt cele obișnuite: umflătură, înroșire, usturime la locul injecției în majoritatea cazurilor. Reacții precum febră, plâns continuu, iritabilitate, lipsa poftei de mâncare apar în aceeași măsură și la grupurile de control, iar convulsiile apar la 3 cazuri dintr-o mie (una dintre meta-analize n-a găsit nici măcar atâtea, dar să zicem că sunt trei). Nicio reacție adversă de lungă durată, nicio vătămare sau sechelă permanentă și niciun deces.94 Ca să înțelegeți mai bine o să iau un exemplu dintre studiile incluse în meta-analizele pe care le-am citat: un studiu clinic randomizat, în care au fost administrate 230.000 de doze de vaccin Hib, studiu realizat de Institutul Național de Sănătate Publică din Finlanda și publicat în 1990 în New England Journal of Medicine.95 A evaluat mai multe lucruri, iar în ce privește efectele adverse a găsit 31 de reacții asociate cu vaccinurile (febră, iritabilitate, reacții locale), nicio reacție anafilactică, niciun deces, nicio sechelă sau vătămare permanentă, un caz de convulsii și un episod hipotonic. Toate reacțiile au fost de scurtă durată și au trecut de la sine.95
Vaccinurile polivalente (combinate)
O bună parte dintre vaccinurile din schema națională sunt administrate combinate, așa că merită să vorbim un pic și despre acest lucru: vaccinuri tetravalente, pentavalente, hexavalente etc.. Un exemplu este Infanrix Hexa, un vaccin polivalent care conține DTaP, HepB, VPI și Hib. Folosirea acestor vaccinuri combinate este utilă din mai multe puncte de vedere, printre care costul, reacțiile adverse mai puține și faptul că e doar o injecție în loc de cinci sau șase. Am văzut mai sus care este situația fiecărui vaccin în parte, așa că pentru a evalua vaccinurile combinate e nevoie să verificăm două lucruri: dacă eficiența componentelor individuale nu scade și dacă nu apar efecte adverse în plus. Pentru că deja se știe eficiența individuală a componentelor, uneori se obișnuiește să se măsoare doar concentrația de anticorpi atunci când se verifică dacă un vaccin combinat este eficient. Din acest motiv poate, cei care sunt împotriva vaccinurilor obișnuiesc să afirme că eficiența vaccinurilor n-a fost dovedită, ignorând faptul că atunci când este testat un vaccin cu mai multe componente știm deja că ele sunt eficiente.
O să dau câteva exemple de studii care au evaluat diverse vaccinuri combinate. Avem de exemplu un studiu clinic randomizat din 2006 cu aproape 700 de participanți, în care a fost verificat efectul pe care îl are administrarea vaccinului ROR împreună cu PCV7 (pentru pneumococi), comparativ cu ROR administrat singur.96 În ambele grupuri copiii au primit şi vaccinul Hib. Nivelurile de anticorpi au fost asemănătoare în ambele grupuri, semn că vaccinurile nu au interacționat negativ între ele.
Într-o recenzie sistematică din 2010 au fost verificate un vaccin tetravalent (DTaP-VPI) și unul pentavalent (DTaP-VPI/Hib), iar comparația a fost făcută cu administrarea individuală a componentelor (DTaP, VPI și Hib).97 Rezultatele arată că reacția imună a participanților este la fel și în cazul vaccinurilor combinate și în cazul celor individuale. Efectele adverse au fost și ele asemănătoare, singura diferență fiind durerea la locul injecției, care a apărut mai des în cazul vaccinurilor combinate (dar considerând că astfel se face o singură injecție în loc de mai multe, în practică se reduc efectele locale). De asemenea, dacă în același timp sunt administrate și vaccinurile ROR, HepB sau PCV7 (pneumococi), acestea nu influențează negativ în niciun fel și au reacția imună obișnuită.
Un alt studiu a evaluat diferențele dintre un vaccin pentavalent (DTaP-VPI/Hib) administrat împreună cu vaccinul PCV7 și administrarea lor separată.98 Reacția imună a celor vaccinați a fost asemănătoare în cele două grupuri. La fel și cu efectele adverse, mai exact singurele diferențe au fost că în cazul vaccinurilor combinate au fost mai multe cazuri de febră.
O recenzie a efectelor clinice din ultimii 16 ani ale vaccinului pentavalent DTaP-VPI/Hib a arătat că reacția imună a fost ridicată indiferent de etnia participanților și programul de vaccinare folosit. De asemenea, și vacinurile de tip booster au produs efectele așteptate. În plus, datele din ultimi 10 ani adunate la nivel național în Suedia arată că vaccinul este eficient în controlarea tusei convulsive, de exemplu.99
Un studiu finanțat din fonduri publice din America a inclus peste 200.000 copiii care au primit vaccinul DTaP-VPI, iar 97% dintre ei au primit în aceeași zi și ROR. A fost evaluat riscul de efecte adverse grave (meningită/encefalită, convulsii, atac cerebral, sindrom Guillain-Barré, sindrom Stevens-Johnson, anafilaxie și alte reacții alergice severe, reacții locale grave). Pentru comparație s-au folosit date de dinainte de 2009 de la persoane care au primit vaccinurile DTaP și VPI separat. Nu s-au observat diferențe semnificative.100
Într-o recenzie sistematică făcută de Colaborarea Cochrane au fost evaluate vaccinurile combinate DTP-HepB-Hib (unele cu VPI, altele cu VPO, altele fără niciunul), comparativ cu componentele lor administrate separat. Din cauza lipsei de omogenitate a studiilor incluse, rezultatele sunt considerate neconcludente, însă în general studiile incluse au arătat că și reacțiile imune și efectele adverse sunt asemănătoare, cu excepția componentelor Hib și tetanos care par să aibă o reacție imună un pic mai mică.101
Un alt studiu publicat în JAMA a evaluat datele pe 7 ani legate de folosirea vaccinului DTaP-VPI-Hib și asocierea cu convulsiile febrile și epilepsia. Rezultatele arată că există un risc de convulsii febrile de mai puțin de 4 cazuri la 100.000 vaccinări cu DTaP-VPI-Hib, dar riscul de epilepsie nu este mai mare la cei vaccinați.102
Un studiu clinic randomizat finanțat de compania producătoare, dar înregistrat pe ClinicalTrials.gov, făcut în China a arătat că vaccinul combinat DTaP-VPI-Hib produce aceeași reacție imună și aceleași efecte secundare ca și vaccinurile de control (cele individuale).103
Mai multe recenzii ale vaccinului hexavalent DTaP-HepB-VPI/Hib au arătat că reacția imună și reacțiile adverse sunt asemănătoare cu cele ale vacinurilor individuale. După administrarea a peste 15 milioane de doze nu s-a înregistrat o creștere a efectelor adverse grave. De asemenea, administrarea vaccinului hexavalent împreună cu un vaccin contra rotavirusului este la fel de sigură și eficientă ca și administrarea separată.104
La toate acestea se adaugă studiile anterioare (pe care le-am menționat la fiecare vaccin în parte) care arată că vaccinurile administrate individual funcționează. Sunt studii de multe tipuri, unele sunt studii clinice randomizate, altele sunt observaționale, unele evaluează efectele adverse, altele evaluează reducerea bolilor, iar altele evaluează balanța costuri-beneficii.
Vaccinul ROR (rujeolă-oreion-rubeolă)
Am ajuns și la vaccinul de la care a plecat totul – cel puțin în vremurile moderne. Mișcarea anti-vaccin există de mult, însă a devenit mai vizibilă după celebrul studiu al lui Andrew Wakefield din 1998. Vorbim și despre el, dar nu chiar acum. Să vedem întâi cum se manifestă pojarul, oreionul și rubeola.
Rujeola (pojarul). Cei care sunt împotriva vaccinurilor insistă că pojarul e o boală inofensivă a copilăriei. Pentru mulți așa este, dar nu pentru toți. Există mai multe complicații cauzate de pojar: conjunctivită (foarte comună, fără efecte permanente dacă nu apar infeții bacteriene și nu există deficiență de vitamina A), otită medie (la 14% dintre copiii sub 5 ani care au oreion; riscul scade cu vârsta), laringotraheobronșită (9-32% dintre copiii spitalizați cu pojar), pneumonie (9% dintre copiii sub 5 ani cu pojar; în cazul celor imunocompromiși este principala cauză a morții), diaree (8%, dar risc mai mare pentru cei sub 5 ani sau peste 30 ani), convulsii febrile (0,1-2,3% dintre copii; de obicei sunt fără complicații ulterioare), encefalită (1-3 la 1000, dintre care 10-15% mor, iar alți 25% rămân cu vătămări neurologice permanente), encefalomielită post-infecțioasă (13 cazuri la 1000, dintre care 25% mor și încă 33% rămân cu sechele neurologice pe viață), panencefalită subacută sclerozantă (18 la 100.000 în cazul copiilor sub 1 an și 4-11 la 100.000 în general). Pot să apară și otite, apendicite, hepatite, miocardite, trombocitopenii. În timpul sarcinii, infecția cu pojar poate duce la avort, nașterea unui copil mort sau naștere prematură.105
În România incidența pojarului era în 2013 de 50 de cazuri la 100.000 oameni, încă mare pentru Europa,106 dar mult mai mică decât dacă n-ar fi existat vaccinarea.
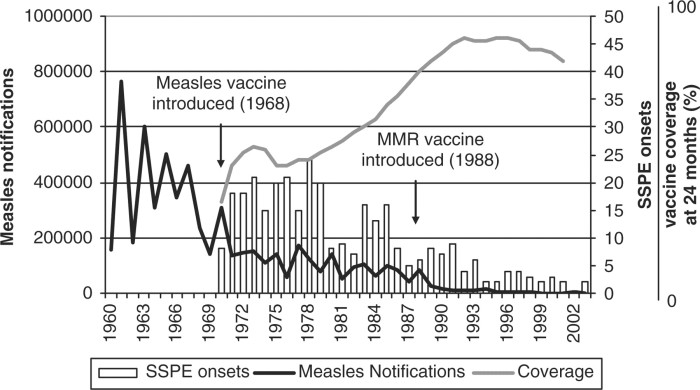
Așadar pojarul nu-i chiar boala inofensivă pe care ne-o prezintă mișcarea anti-vaccin.
Oreionul. Între o treime și o jumătate dintre infecțiile cu oreion sunt asimptomatice sau se manifestă doar prin simptome respiratorii moderate, uneori însoțite de febră. În celelalte cazuri apar umflături ale glandelor (în special ale celor parotide – de aici și numele de parotidită epidemică). Meningita virală apare cam în 1 din 7 cazuri și nu este foarte periculoasă (se manifestă prin sensibilitate la lumină, vărsături, simptome de răceală și ține cam 14 zile). Pancreatita poate să apară la 4% dintre cei infectați. Nu este clar dacă există o legătură între pancreatita urliană și diabet. Meningita apare în 5-10% din cazuri iar encefalita la 1-3‰ (deși e un număr mic, oreionul era principala cauză a encefalitei în SUA până în anii ’70 când a fost introdus vaccinul). Printre simptomele meningoencefalitei se numără febra, vărsăturile, durerile de cap, letargia, durerile abdominale sau convulsiile. Pierderea temporară a auzului apare în 4-5% din cazurile de oreion, iar pierderea permanentă a auzului apare la 1 caz din 20.000.107
În cazul în care oreionul apare la băieții trecuți de pubertate, există și riscul de orhită (inflamarea testiculelor). Aceasta apare la 20-30% din cazuri, dintre care la 10-30% se manifestă bilateral. Fertilitate scăzută se observă la 13%, iar dintre cei cu orhită bilaterală, între 30 și 87% devin infertili.108
Rubeola (pojărelul). În 25 până la 50% din cazuri, efectele rubeolei sunt subclinice. În cazurile în care se manifestă clinic, simptomele includ conjunctivită, febră ușoară, limfadenopatie și stare de rău. O erupție apare și durează 1-3 zile. Boala cauzată de rubeolă este în general benignă, dar au fost observate cazuri foarte rare de artrită, artralgie, encefalită, sindrom Guillain-Barré, panencefalită progresivă sau trombocitopenie. Principalul pericol este dat de sindromul rubeolic congenital, ce poate apărea în timpul sarcinii. Dacă infecția apare în primele 2 luni de sarcină, riscul de defecte congenitale sau avort spontan este de 65-85%; dacă infecția apare în a 3-a sau a 4-a lună de sarcină, există riscul unui singur defect și este de 30-35%; dacă infecția apare în săptămânile 17-20 de sarcină, există doar un risc mic de surzenie. Acest sindrom se manifestă prin cataracte, surzenie, boli cardiace congenitale, afecțiuni ale creierului, ficatului, plămânilor sau ale măduvii oaselor. De asemenea, pot să apară diabet, hipotiroidism, hipertiroidism sau inflamări ale creierului.109
Pentru prevenția acestor trei boli avem vaccinul ROR. Să vedem cât de bine funcționează.
Să ne uităm la ce spune o recenzie sistematică făcută de Colaborarea Cochrane (o organizație independentă, fără nicio legătură cu industria, dacă e nevoie să spun) care a inclus peste 14 milioane de copii: eficiența contra cazurilor de pojar este de 95%, iar contra oreionului este de 83-88% (pentru două doze de vaccin).110
Mai avem informații și din alte părți. De exemplu, o recenzie sistematică din China a evaluat eficiența vaccinului ROR contra oreionului și a găsit o valoare asemănătoare cu cea găsită de Cochrane: 85-88%.111 O altă recenzie arată valori asemănătoare: vaccinul ROR este eficient contra oreionului în proporție de 88-92%.112
Există și alte moduri în care se pot vedea efectele vaccinării cu ROR. În mai multe țări s-au făcut studii care au pus în balanță costurile și beneficiile, s-au uitat la cât de mult au fost reduse bolile (cele care necesită intervenție medicală) și cât de util este să fie folosit vaccinul. Există nenumărate exemple de astfel de studii (și nu sunt studii post-marketing făcute de companiile farmaceutice). În Statele Unite se estimează că vaccinul ROR a avut un beneficiu de 3,5-7,6 miliarde de dolari (asta pentru că oamenii nu s-au mai îmbolnăvit și n-au mai avut nevoie de îngrijire medicală), ceea ce înseamnă un raport costuri-beneficii extrem de mare. Asemănător e și în Coreea de Sud (studiul a evaluat doar pojarul) și în Germania (aici studiul a evaluat doar pojarul și rubeola) și la nivel mondial. De asemenea, dacă ne uităm doar la rubeolă observăm tot beneficii majore.113
Avem așadar mai multe tipuri de studii (studii clinice, studii observaționale de mai multe feluri, estimări risc-beneficiu) și toate indică în aceeași direcție: vaccinul ROR funcționează.
Să vedem care sunt efectele adverse. Pentru asta ne putem uita la mai multe recenzii sistematice, dar nu numai. Dacă tot am vorbit mai sus despre o recenzie făcută de Colaborarea Cochrane, să începem cu ea.110 Au fost evaluate și efectele adverse pe lângă eficiență și au rezultat următoarele: vaccinul ROR care folosește tulpina Urabe de oreion dă un risc mai mare de meningită aseptică; indiferent de tulpină, vaccinul ROR crește riscul de convulsii febrile și purpură trombocitopenică; tot indiferent de tulpină, vaccinul ROR nu crește riscul de autism, astm, leucemie, rinită alergică, diabet, disbazie (dificultate la mers), boală Crohn, boli de demielinizare sau infeții bacteriene și virale.
Tulpina Urabe nu este folosită nici în România, nici în Moldova (și nici în majoritatea celorlalte țări). În România și Moldova este folosită tulpina Jeryl Lynn care nu crește riscul de meningită. Numele comercial al vaccinului este Priorix.
Purpura trombocitopenică de obicei trece de la sine, dar există și cazuri grave așa că haideți să vedem niște numere legate de ROR. O să mă folosesc de două studii ce s-au concentrat pe legătura dintre această afecțiune și vaccinuri: o recenzie sistematică din The Journal of Pediatrics și un studiu mare de cohortă (cu 1,8 milioane de copii) din Pediatrics.114 Recenzia a descoperit că numărul de cazuri de purpură trombocitopenică produse de ROR este între 0,087 și 4 la 100.000 doze de vaccin, iar complicațiile au fost foarte rare. Studiul de cohortă a identificat 197 de cazuri de purpură trombocitopenică în urma mai multor vaccinuri, doar asocierea cu ROR a fost semnificativă din punct de vedere statistic și doar un singur caz a fost grav și a avut nevoie de transfuzii. Pe scurt, riscul de purpură trombocitopenică gravă este de 1 la 1,8 milioane.
Despre convulsiile febrile am mai spus că nu sunt periculoase decât dacă sunt asociate cu alte probleme, cum ar fi epilepsia, dar nu este cazul aici.
Încă două recenzii sistematice masive, una realizată de Institute of Medicine, plus altele care s-au concentrat pe probleme specifice (ex. scleroză multiplă, sindrom Guillain-Barré, anafilaxie), au fost evaluate efetele adverse ale vaccinului ROR și a fost găsit în mare parte același lucru: doar tulpina Urabe crește riscul de meningită aseptică, pentru toate tulpinile există risc de purpură trombocitopenică, de convulsii febrile, de encefalită rujeolică (doar pentru cei imunodeficienți), de anafilaxie (reacțiile alergice apar cam la un caz dintr-un milion de vaccinați, iar anafilaxia cam la un caz dintr-un milion și jumătate de vaccinați în cel mai rău caz și 1 caz la 7,6 milioane de vaccinați în cel mai bun), posibil risc de atralgie la femei (adică dureri de articulații, și doar trecătoare). Nu există indicii care să arate că vaccinul ROR ar provoca următoarele: scleroză multiplă, encefalită sau encefalopatie, convulsii afebrile, meningită, ataxie, autism, encefalomielită diseminată, mielită transversă, neurită optică, neuromielită optică, sindrom Guillain-Barré, polineuropatie inflamatorie cronică diseminată, sindrom opsoclonus myoclonus, neurită brahială, atralgie cronică, artrită cronică, artropatie, diabet, hepatită, sindromul oboselii cronice, fibromialgie, pierderea auzului, PESS (panencefalită subacută sclerozantă – vezi și graficul de mai sus).115
Pentru mine povestea cu legătura dintre ROR și autism este una dintre cele mai plictisitoare. În articolele anterioare (despre Piersicuța, despre lista de „studii”) am sărit peste părțile despre autism. Aș cam sări și acum, dar pe urmă cei anti-vaccin o să creadă că evit subiectul din alte motive. Așa că…
Totul a început cu articolul publicat de Andrew Wakefield în 1998 în The Lancet, articol numit „Ileal-lymphoid-nodular hyperplasia non-specific colitis, and pervasive developmental disorder in children” și retras abia în 2010.116 Studiul pe care l-a făcut Wakefield a inclus doar 12 copii (cu unul mai puțin decât numărul de autori, aș adăuga) și a propus un nou sindrom (enterocolită autistică) prin care ar fi făcută o legătură între autism, probleme intestinale și vaccinul ROR. În articol nu este demonstrată o legătură cauzală, dar Wakefield s-a gândit că ar fi cool să stârnească un pic de panică, așa că înainte ca articolul să fie publicat a ținut o conferință de presă în care a cerut să se oprească vaccinarea ROR. Pentru claritate, redau concluzia studiului lui Wakefield:
We did not prove an association between measles, mumps and rubella vaccine and the syndrome described.
[Nu am demonstrat o asociere între vaccinul rujeolă-oreion-rubeolă și sindromul descris.]
După publicare studiul a devenit controversat având în vedere că existau și au fost făcute ulterior alte studii care arătau contrariul. În 2004, un jurnalist de investigație (Brian Deer) a descoperit că Wakefield a fost plătit pentru „cercetarea” sa de către un avocat care plănuia să dea în judecată un producător de vaccinuri. În 2007, General Medical Council din Marea Britanie a făcut o investigație din care a rezultat că Wakefield a fost „iresponsabil și necinstit”. Prin urmare, i-a fost retras dreptul la practică medicală, dar deja emigrase în Statele Unite. Reacția sa a fost să se victimizeze, să acuze „sistemul” că îl persecută și îi suprimă „cercetarea” și să scrie cărți ca să facă bani. În 2004, 10 din cei 13 autori ai studiului și-au retras susținerea față de asocierea ROR-autism, dar nu și Wakefield.117 Și astfel a devenit el eroul mișcării anti-vaccin, că dacă n-ar fi, nu s-ar povesti.
Retragerea din Lancet a venit după investigațiile făcute de General Medical Council și de Brian Deer, jurnalistul care a descoperit inițial legăturile financiare ale lui Wakefield. N-o să intru în detalii, dar studiul lui Wakefield este și slab din punct de vedere științific, nici nu demonstrează ceea ce susține autorul prin conferințe de presă și conține date falsificate. Dacă vreți să aflați toată povestea, vă recomand articolul lui Brian Deer din BMJ: How the case against the MMR vaccine was fixed.118
Chiar dacă Wakefield nu și-ar fi falsificat datele, tot ar fi fost irelevant pentru că este un studiu mic, cu 12 copii, care nici măcar nu demonstrează vreo legătură, așa că încercarea anti-vacciniștilor de a-l face erou e degeaba. Ori cu el, ori fără el, din punct de vedere științific situația e aceeași pentru că există multe studii care demonstrează contrariul, iar replicarea studiului său original a eșuat.119 Pe scurt, e doar un om care a primit mult prea multă atenție.
Bun, să ne uităm la studii de calitate care au verificat dacă există vreo legătură între ROR și autism. O să dau câteva exemple și din lipsă de alte idei o să le prezint în ordine cronologică.
Un studiu din 2000, făcut în Finlanda cu 1,8 milioane de oameni care au primit 3 milioane de vaccinuri. Au fost observate mai multe efecte adverse (77 de natură neurologică). Dacă ar exista o relație de cauzalitate (nu există, dar dacă ar exista), ar fi 3,2 efecte adverse severe la 100.000 vaccinuri.120 Studiul lui Wakefield a avut 12 participanți.
- Recenzie a studiillor de până atunci care au evaluat relația dintre ROR și „autism regresiv” (ceea ce a propus Wakefield). Nicio legătură.121
- Evaluare a legăturii ROR-autism, făcută în Scoția. Nicio legătură.122
- Recenzie sistematică publicată în JAMA. Nicio legătură între vaccinuri și autism.123
- Un studiu care a analizat 2400 de copii cu autism și 4600 dintr-un grup de control n-a găsit nicio legătură între autism și virusul pojarului sau vaccinul ROR.124 Studiul lui Wakefield a avut 12 participanți.
- Japonia. 300.000 copii din districtul Kōhoku din Yokohama, născuți între 1988 și 1996. În 1993 se oprește vaccinarea cu ROR. Incidența autismului este neafectată: din 1988 până în 1993 fluctuează puțin începând creșterea din 1992. Între timp, procentul de copii vaccinați cu ROR scădea. După 1993 incidența autismului continuă să crească, deși nu se mai făcea vaccinul.125 Dacă ați uitat, studiul lui Wakefield a avut 12 participanți.
2006. Canada. Studiu cu 27.000 copii nu găsește nicio legătură între autism și ROR. De asemenea, nici o recenzie a literaturii științifice nu găsește vreo legătură.126 Studiul lui Wakefield a avut 12 participanți.
2010. Studiu care a verificat concentrația de mercur din sângele copiilor cu și fără autism. N-a găsit nicio diferență. În schimb, a găsit o diferență între cei care mâncau mult pește și cei care mâncau puțin pește.127
2012. Recenzia despre ROR făcută de Cochrane și cea făcută de Institute of Medicine nu găsesc nicio asociere între ROR și autism.128 În total au fost câteva millioane de participanți. Wakefield a avut 12 milioane. Scuze, 12 copii.
2013. Studiu caz-control cu 256 de copii cu autism și 752 fără, a găsit că expunerea la proteine și polizaharide care stimulează anticorpii nu este asociată cu o creștere a riscului de autism.129 Tot 12 participanți pentru Wakefield.
2014. Meta-analiză ce a inclus peste 1.250.000 copii în studii de cohortă și aproape 10.000 în studii caz-control. Rezultatele arată că nici vaccinul ROR, nici timerosalul nu sunt asociate cu vreun risc de autism.130 În continuare 12 participanți pentru Wakefield.
2015. Studiu mare cu aproape 100.000 participanți, publicat în JAMA. Din nou nicio legătură între autism și ROR.131 Al lui Wakefield a avut 12.
Cred că am epuizat subiectul și este clar că vaccinul ROR nu produce autism. Sau ca să împrumut tactica anti-vacciniștilor atunci când vor să demonstreze ceva:
VACCINUL ROR NU PRODUCE AUTISM!!!
Vaccinul contra rotavirusului
Nu este inclus în schema națională din România (încă), dar este recomandat. Este inclus în schema națională din Moldova și este recomandat de OMS. După cum ne-am obișnuit, să vedem întâi care sunt problemele pe care le face rotavirusul.
Boala produsă cel mai des de rotavirus este gastroenterita acută, manifestată prin diaree, vărsături și febră. Cea mai comună complicație care poate apărea este deshidratarea. Dacă diareea nu este tratată corespunzător poate duce la malnutriție (pentru că abilitatea intestinului de a absorbi nutrienți este blocată) și ca urmare este asociată cu probleme cognitive în primii ani de viață. Bineînțeles, dacă malnutriția există și din alte cauze (sociale, economice), cresc riscurile. Se estimează că sunt 24 milioane de vizite la doctor și 2,4 milioane de vizite la spital din cauza rotavirusului la nivel mondial în fiecare an. În 2004 (înainte de vaccin), 5% dintre toate decesele în cazul copiilor sub 5 ani au fost produse de rotavirus. E important de menționat că peste 80% din decese sunt produse în țările sărace. Motivele sunt mai multe și țin și de nutriție și de serviciile medicale disponibile. La fel de important e și faptul că incidența infecțiilor cu rotavirus nu e diferită în țările sărace și în cele bogate, după cum arată o recenzie sistematică. Cu alte cuvinte, riscul de a ne îmbolnăvi cu rotavirus este la fel de mare și dacă locuim în Etiopia și dacă locuim în SUA. Ce diferă e însă riscul de a muri. În SUA o să avem acces la un sistem medical care ne poate rezolva problemele, în timp ce în Etiopia șansele sunt mai mici. Ar mai fi de spus și că rata de infecție era în creștere înainte de introducerea vaccinului. Astfel, în perioada 1986-1999 doar 22% din cazurile de diaree la copii erau produse de rotavirus, în timp ce în perioada 2000-2004, rata a crescut la 39%.132
Pentru prevenire există vaccinuri. Cât de eficiente sunt?
Cel mai util este să ne uităm la ce s-a întâmplat în diverse țări în care au fost introduse aceste vaccinuri. Sunt o mulțime de exemple, dar cum nu vreau ca jumătate din referințele acestui articol să fie despre rotavirus, o să prezint doar câteva.
Să ne uităm un pic la America Latină. În Mexic, de exemplu, în 2007 au fost vaccinați 74% dintre copiii cu vârsta de până la 11 luni cu o singură doză de vaccin. În 2008, mortalitatea produsă de diaree a scăzut de la 61,5/100.000 la 36/100.000, în timp ce mortalitatea la copiii nevaccinați a rămas la fel. În regiunea nordică, mortalitatea copiilor sub 5 ani a scăzut de la 8,3/100.000 la 4,5/100.000. Scăderi asemănătoare au fost înregistrate și în celelalte regiuni ale țării.133 În imagini arată cam așa:

În Brazilia, un studiu care a comparat situația din anii 2002-2005 (înainte de vaccin) cu cea din anii 2007-2009 (după vaccin) a descoperit că pentru copiii sub 5 ani mortalitatea cauzată de diaree a scăzut cu aproximativ 1500 cazuri, iar internările în spital cu 130.000. Cel mai mare efect a fost observat la copiii sub 2 ani pentru că la ei a fost rata cea mai mare de vaccinare. Pentru control, scăderea numărului de decese și de internări în spital a fost cea mai mică în cazul celor care n-au fost eligibili pentru vaccinare și astfel au trebuit să se bazeze doar pe imunitatea de grup. Un alt studiu, care a comparat datele din perioada 1998-2007 pentru gastroenterită a găsit rezultate asemănătoare.134
În El Salvador în perioada post-vaccin (2008-2009) au fost cu 81% mai puține spitalizări din cauza infecțiilor cu rotavirus (e vorba de copii sub un an care au primit două doze de vaccin; acoperire națională de doar 50%), comparativ cu perioada pre-vaccin (2006).135 În Panama după introducerea vaccinului a scăzut cu 50% mortalitatea dată de gastroenterită.136
Să mergem mai la nord: Statele Unite. Folosind datele despre spitalizare din 18 state au fost calculate ratele cu care a apărut gastroenterita acută (formele grave care aveau nevoie de spitalizare) înainte de 2006 și după 2006. Intuiți bine că în 2006 a fost introdus vaccinul. În doar doi ani de la introducere, ratele de gastroenterită acută au scăzut de la 101,1/10.000 la 55/10.000.137 Un alt studiu care s-a uitat la primii trei ani după vaccin a găsit rezultate asemănătoare pentru copiii sub 5 ani: spitalizările din cauza gastroenteritei au scăzut dramatic.138
În Queensland, Australia, infecțiile cu rotavirus la copiii sub 2 ani au scăzut cu 53% în 2007 și cu 65% în 2008, comparativ cu situația de dinainte de introducerea vaccinului.139
În Belgia, numărul de spitalizări din cauza gasroenteritei produse de rotavirus era de 19% (din toate cazurile de gastroenterită) înainte de vaccin și a scăzut la 12,4%, apoi la 9,6%, apoi la 6,4% în anii următori. Practic, introducerea vaccinului a redus cazurile de gastroenterită produsă de rotavirus cu 66% în doar trei ani.140 Dar să nu ne uităm doar la Belgia, să ne uităm la întreaga Europă. O recenzie care s-a uitat la toate datele din perioada 2006-2014 arată că problemele produse de rotavirus ce au nevoie de servicii medicale s-au redus cu 68-98%, iar spitalizările cu 65-84%.141
Aș putea continua. Dacă mai vreți alte exemple, puteți căuta pentru început studii despre Africa de Sud, Malawi, Taiwan etc. O să găsiți aceleași efecte benefice ale vaccinului pentru rotavirus.
Astea sunt efectele practice, în teren. Dacă vreți studii clinice randomizate, există și așa ceva. De exemplu, un studiu de acest tip a fost publicat în JAMA în 2006, fiind în prealabil înregistrat pe ClinicalTrials.gov. A cuprins 63.225 copii din 11 țări, copii care au primit ori două doze de vaccin pentru rotavirus, ori placebo (tot de două ori, firește; prima dată la 2 luni, apoi la 4 luni). Comparând cele două grupuri s-au observat următoarele: numărul de spitalizări din cauza gastroenteritei produse de rotavirus a fost mai mic cu 85% la cei vaccinați, numărul de cazuri severe fiind redus cu 100%; iar spitalizările din cauza diareei (indiferent de cauză) au fost cu 42% mai rare la cei vaccinați.142
O recenzie sistematică făcută de Colaborarea Cochrane în 2012 a arătat că pentru copiii sub 1 an, vaccinul contra rotavirusului previne 86% dintre cazurile severe de diaree produse de rotavirus și cam 40% din toate cazurile de diaree severă în țările cu mortalitate mică, iar în țările cu mortalitate mare, previne 63% din cazurile de diaree severă produse de rotavirus și 34% din toate cazurile de diaree severă. Au fost studiate ambele vaccinuri (Rotarix și RotaTeq) și au avut efecte asemănătoare.143
Să vedem și efectele adverse. Dacă tot am menționat studiile de mai sus142, 143 să vedem ce zic despre siguranță. În studiul clinic 6 copii vaccinați au făcut invaginație intestinală, dar și 7 din grupul de placebo. În recenzia sistematică s-au observat rate asemănătoare de invaginație și la cei din grupul placebo și la cei vaccinați. Prin urmare, concluzia pe care o putem trage este că vaccinul nu crește riscul de invaginație intestinală.
O altă recenzie sistematică ce a inclus și studii observaționale a găsit un exces de 82 cazuri de invaginație la 7.691.757 vaccinuri.144 Iar alta din 2014 a găsit următoarele:145 efectele secundare comune sunt nas înfundat, iritabilitate și tuse, iar în ce privește invaginația, studiile clinice randomizate au arătat că vaccinurile nu cresc riscul, dar există câteva studii observaționale care arată un risc, cel mai probabil de 1,5 cazuri la 100.000 vaccinuri pentru RV5 (RotaTeq) și 5,1/100.000 pentru RV1 (Rotarix). Merită să ne uităm un pic mai atent la ele.
Unul este din Statele Unite, a inclus 1.200.000 doze de vaccin, dintre care 507.000 au fost „prima doză”. E important de menționat acest detaliu pentru că după prima doză e riscul cel mai mare. Au fost înregistrate 343 cazuri suspecte de invaginație, dintre care doar 124 au putut fi confirmate clar și au fost incluse în analiza principală. Autorii concluzionează: „am găsit probe care arată o asociere între RV5 [vaccin contra rotavirusului] și invaginație. Riscul este cel mai mare în perioada de 3 până la 7 zile după prima doză. Riscul estimat asociat cu doza numărul 1 de RV5 a fost aproximativ 1,5 cazuri în exces la 100.000 de recipienți ai primei doze”. Pentru RV1, au fost mai puțini participanți, motiv pentru care valoarea de 5,1 la 100.000 nu este așa de precisă.146
Un alt studiu, de această dată din Australia, a găsit 192 cazuri de invaginație, dintre care doar 92 la cei vaccinați. Autorii menționează și că nu s-a înregistrat niciun deces. Luându-ne după aceste date, vaccinul nu pare să crească riscul de invaginație.147 Un studiu din Mexic a găsit 750 cazuri de invaginație (dar cum populația inclusă a fost în mare parte vaccinată, doar în jur de 50 au apărut în categoria celor nevaccinați, ceea ce îngreunează estimările). Riscul calculat a fost de 3,7 cazuri în exces de invaginație la 100.000 vaccinuri.148 Un alt studiu, din Statele Unite a inclus 786.000 de doze de vaccin și a concluzionat că riscul de invaginație nu este crescut din cauza vaccinului.149
Așa că avem niște date contradictorii. Ce facem? Avantajul este că rezultatele par să se învârtă în jurul unei valori de câteva invaginații în exces la 100.000 vaccinuri. Propun să luăm în calcul un potențial risc de 1,5 sau 5,1 invaginații la 100.000 vaccinuri și să vedem în ce parte înclină balanța beneficii-riscuri.
Dar până atunci, să facem o mică incursiune în care să aflăm mai multe despre această problemă numită invaginație intestinală. Ea e motivul pentru care un vaccin mai vechi contra rotavirusului a fost retras de pe piață mai demult. Este vorba de RotaShield care s-a descoperit că are un risc de a produce invaginații de 1/10.000.150
Invaginațiile apar din motive care nu sunt foarte clare încă, iar frecvența cu care apar la nivel mondial este în medie de 70 la 100.000 copii sub 1 an, iar cel mai des apar la vârsta de 5-7 luni. Cele mai multe cazuri nu sunt grave, dar există și riscul de deces. Fatalitatea este mai mare în zonele în care accesul la servicii medicale este mai greu (din diverse cauze, cum ar fi și sărăcia și lipsa de educație și altele). De exemplu, o rată foarte mare de decese se înregistrează în Africa, unde 9% dintre copiii cu invaginație mor. În Europa, riscul este în jur de 0,1%. Un exemplu interesant este Japonia, unde această problemă apare mai des decât în alte țări dezvoltate. Se înregistrează între 180 și 190 cazuri la 100.000 copii, dintre care 93% se vindecă prin clismă, iar celelalte au nevoie de operație. În 2007 și 2008 au existat 2.427 cazuri de invaginație, dintre care două decese. Asta înseamnă o fatalitate de 0,082%.151
Ca să avem o imagine mai clară, mai dau trei exemple (toate datele sunt de dinainte de introducerea vreunui vaccin pentru rotavirus). În Statele Unite în perioada 1995-1997 frecvența invaginațiilor era între 18 și 56 la 100.000 copii sub 1 an. Riscul de deces era de 2,3 la milion. În Israel în perioada 1992-2009, rata invaginațiilor era de 23-36 la 100.000 copii. În Marea Britanie, rata era de 24 la 100.000 (cu un vârf de risc în a 5-a lună de viață: 50,3/100.000).152
E important de reținut că riscul de invaginație este mare cu sau fără vaccin, iar un vaccin contra rotavirusului crește riscul cu foarte puțin. De asemenea, riscul cel mai mare este la vârsta de sub 1 an și în special la cea de 5-7 luni. Până la un an de zile se fac trei sau patru ture de vaccinuri, așa că cele mai multe dintre cazurile de invaginație care o să apară după un vaccin o să fie coincidențe. Dar o să existe și 1-2 la 100.000 copii vaccinați, care n-o să fie coincidențe. Am citit sfaturi care recomandau părinților să fie atenți câteva zile după vaccin la semne care ar putea indica o invaginație. Având în vedere numerele pe care le-am prezentat mai sus, cred că este mult mai important ca părinții să fie atenți la astfel de semne tot timpul în primul an de viață al copilului. O atenție sporită poate evita complicații neplăcute.
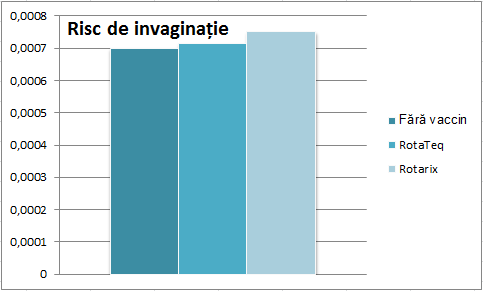
Am zis că vorbim despre partea în care înclină balanța riscuri-beneficii pentru vaccinurile pentru rotavirus. Am găsit trei studii care exact asta încearcă să afle. Unul este din Statele Unite, s-a folosit de o cohortă de 4,3 milioane de copii și –luând în calcul riscul de 1,5 cazuri la 100.000 vaccinuri– arată că pe această populație vaccinurile pentru rotavirus produc un exces de 0,2 decese, 45 spitalizări și 13 vizite la urgențe. În același timp, vaccinurile previn 14 decese produse de rotavirus, 53.444 spitalizări și 169.949 vizite la urgențe. Astfel, raportul beneficii-riscuri este de 71:1 în cazul deceselor și 1093:1 în cazul spitalizărilor.153 O analiză asemănătoare a fost făcută și în Marea Britanie (luând în considerare riscul de 5,1/100.000) și a arătat că pentru fiecare deces produs de vaccinul pentru rotavirus, sunt prevenite altele 88.154 În cazul țărilor mai sărace balanța înclină și mai tare. O analiză făcută în America Latină a descoperit un raport beneficii-riscuri de 395:1 pentru decese și 841:1 pentru spitalizări.155 Spus altfel, în America Latină vaccinurile pentru rotavirus salvează 395 vieți înainte să ia una. O astfel de analiză nu s-a făcut în România, dar nu cred că greșesc dacă spun că ne-am plasa undeva între America Latină și SUA sau UK. Oriunde ne-am plasa, vaccinarea ar auce beneficii de cel puțin câteva zeci –dacă nu chiar sute– de ori mai mari decât riscurile.
Luând toate acestea în considerare, ar trebui să fie cât se poate de clar că vaccinurile contra rotavirusurilor sunt o poveste de succes.156
Alte informații de final
Am încercat mai sus să prezint studii care să arate care sunt riscurile bolilor prevenibile prin vaccinare, eficiența fiecărui vaccin și efectele sale adverse. Am încercat să găsesc studiile de calitate cât mai mare și cele mai noi pentru ca informațiile să fie cât mai exacte. Nu pot garanta că le-am găsit pe cele mai bune, dar am făcut tot posibilul. Mai sunt câteva lucruri de zis și o să fac asta acum.
Mie întotdeauna când văd numere (mai ales foarte mari sau foarte mici) îmi place să le compar cu ceva. Reușesc să înțeleg mai bine ce înseamnă dacă am ceva cu care să le compar. Din acest motiv am încercat să ofer și riscurile bolilor și riscurile vaccinurilor pentru că o valoare cum ar fi „1 la 100.000” nu pare foarte ancorată în realitate dacă nu avem un termen de comparație. Și o să mai fac un lucru: o să prezint niște riscuri pe care le întâlnim și de care nu suntem conștienți. O să încep cu un medicament banal –aspirina–, o să continui cu remedii naturale și o să închei cu riscuri care nu sunt legate de medicină.
Aspirina.
Aspirina luată pe termen lung pentru probleme cardiovasculare este asociată cu un risc crescut de sângerări extracraniene și un trend spre accidente vasculare cerebrale. În cazul celor cu diabet există riscul de hemoragii, inclusiv gastrointestinale. Iar în cazul celor cu „rezistență la aspirină” crește riscul de evenimente cerebrovasculare, sindrom coronarian acut sau chiar deces. Aspirina de asemenea poate duce la complicații din cauza hemoragiilor gastrointestinale și a perforațiilor, iar rata deceselor a continuat să crească la utilizatorii de aspirină, din 1997 până în prezent. În numere, folosirea aspirinei crește riscul de hemoragii majore cu 70% și dublează riscul de hemoragii gastrointestinale (atenție, vorbesc de riscuri relative). În termeni absoluți, aceste valori nu sunt mari pentru că riscurile de hemoragii sunt mici (și chiar dacă dublăm un număr mic, tot mic rămâne). Exprimat altfel, din 106 persoane care fac tratament de lungă durată cu aspirină, 1 suferă o hemoragie gastrointestinală.157 Iar aceste hemoragii pot să aibă complicații, cum ar fi șocul hemoragic, ce poate să ducă la moarte.
Remediile naturale.
Remediile naturale au marea problemă că au fost testate foare puțin sau deloc. În general sunt vândute ca suplimente alimentare și din acest motiv nu sunt supuse la aceleași teste ca și medicamentele (a auzit cineva de teste post-marketing pentru suplimente alimentare?). Așa că e posibil să aibă multe riscuri nedescoperite. Fiind naturale nu înseamnă că nu au efecte secundare. Pentru exemplificare, propun să ne uităm la unele care au fost testate cât de cât.
De exemplu, ginkgo biloba poate produce hemoragii (apropo, ginkgo biloba nici nu ajută memoria); sunătoarea poate produce tulburări gastrointestinale sau reacții alergice; efedra (ma huang) poate produce hipertensiune, aritmie cardiacă, convulsii, evenimente cerebrovasculare, infarct miocardic, pietre la rinichi; kava poate produce dischinezie, torticolis, crize oculogire sau poate intensifica boala Parkinson.158 Mai multe suplimente alimentare produc probleme la rinichi (nefrotoxicitate, nefrolitiază, insuficiență renală acută, sindrom hepatorenal).159 Deși pare incredibil, chiar și homeopatia poate avea efecte adverse din cauza unor substanțe ce rămân din procesul de producție.160 Și mai sunt multe alte exemple.161 Marele dezavantaj este însă că siguranța unor astfel de produse nu este studiată suficient (și uneori nici eficiența, dar asta e altă discuție).
Alte riscuri.
Zi de zi ne supunem foarte multor riscuri. De exemplu, riscul de a muri într-un accident de mașină este de 11,1 la 100.000 locuitori (sau 47,3/100.000 mașini) în România și de 13,9 la 100.000 locuitori (sau 77,5/100.000 mașini) în Moldova (Wikipedia). Chiar și dacă nu ieșim din casă, tot suntem supuși la riscuri: în România au loc cam 22 incendii la 100.000 locuitori (dacă n-am greșit calculele). Dacă vreți și alte exemple de riscuri, puteți citi articolul «Noi să fim sănătoși!».
Alți factori de luat în calcul.
Pe lângă toate informațiile de aici, la utilitatea (și necesitatea) vaccinurilor se adaugă și informațiile istorice. Mișcarea anti-vaccin vine cu multe statistici pe care le interpretează greșit și bineînțeles că nu prezintă toată povestea, prezintă doar acele statistici care arată „ce trebuie”. N-am mai reluat subiectul în acest articol pentru că l-am tratat în articolul pe care l-am menționat la început. Realitatea istorică arată că incidența bolilor contagioase a scăzut masiv doar la introducerea vaccinurilor. Alte lucruri nu au avut nici pe departe un asemenea efect, oricât ar încerca să ne convingă cei anti-vaccin că de fapt apa și săpunul au dus la dispariția bolilor contagioase. Apa și săpunul sunt foarte bune, dar nu ne pot scăpa de bolile răspândite de virusuri și bacterii (din nefericire). Ar fi bine dacă ar putea. Prin urmare, atunci când luăm o decizie în privința vaccinării trebuie să ne uităm la situația de dinainte de introducerea vaccinurilor. Chiar dacă nu s-au mai înregistrat cazuri de poliomielită de ani de zile în România, chiar dacă riscul de a face difterie sau tuse convulsivă este mic, este important să știm de ce este mic: pentru că există programe de vaccinare. În ultima vreme acoperirea vaccinurilor a scăzut destul de mult din două motive: incompetența ministerului de a asigura vaccinurile la timp și influența negativă a mișcării anti-vaccin. Scăderea gradului de vaccinare vine cu riscuri. Ar fi mai multe de discutat despre motivele pentru care unii părinți aleg să nu își vaccineze copiii, dar nu în acest articol pentru că este deja destul de lung.
Concluzii
Ce-am încercat și ce-am reușit în acest articol?
Am încercat să ofer studii de calitate care să arate cât de eficiente și cât de sigure sunt vaccinurile – cu numere, acolo unde am găsit. Într-un articol precedent am criticat calitatea slabă (și lipsa de înțelegere) a articolelor anti-vaccin, așa că pentru comparație o să zic câteva lucruri și despre referințele pe care le-am citat eu aici. În total sunt 217 referințe, iar media anilor de publicare este 2008, deci nu putem spune că sunt învechite. Mai mult de jumătate (51,4%) sunt articole din următoarele jurnale științifice de top: BMJ, The Lancet, JAMA, NEJM, Pediatrics, Vaccine, PLOS, Clinical Infectious Diseases, The Journal of Infectious Diseases, The Pediatric Infectious Disease Journal sau recenzii sistematice Cochrane. N-am numărat și alte jurnale de top precum International Journal of Epidemiology, The Journal of Pediatrics, Neurology sau Journal of Pathology. Iar specializările jurnalelor sunt pe tema articolelor, nu am citat articole despre vaccinuri și autism publicate în, să zicem, jurnale de chimie organică. Mai mult, am încercat să mă folosesc de articole care sunt cât mai sus în piramida dovezilor. Piramida arată cam așa… cel puțin în formă de tort:

Și nu, nu mă bazez pe un tort când vorbesc de ierarhia cercetării. Există cercetare și în domeniul ăsta (meta-cercetare, dacă vreți).162 Puteți vedea aici un tabel mai detaliat despre ierarhia cercetării, tot de la Centre for Evidence-Based Medicine. Putem vedea, de exemplu, că beneficiile unui tratament sau ale unei intervenții sunt descoperite cel mai bine prin:
- recenzii sistematice de studii clinice
- studii clinice individuale sau studii observaționale cu efect dramatic
- studii de cohortă nerandomizate
- serie de cazuri, studii caz-control etc.
- raționament bazat pe mecanism
Pentru evaluarea efectelor adverse ierarhia este asemănătoare, cu precizarea că avem la primul nivel și recenzii sistematice de studii observaționale sau caz-control hibride. Bineînțeles că această ierarhie nu trebuie aplicată rigid și trebuie luate în considerare și alte detalii, cum ar fi de exemplu numărul de participanți. Însă studii care fac raționamente bazate pe mecanism (așa cum sunt cele citate de mișcarea anti-vaccin pentru a lega, de exemplu, aluminiul din vaccinuri cu vătămările neurologice) nu pot să înlocuiască studii de calitate, aflate cu câteva niveluri mai sus.
Am încercat și să fac o comparație între riscurile date de bolile prevenibile și riscurile date de vaccinuri și o altă comparație între riscurile și beneficiile vaccinurilor. Am încercat să contrazic mai multe afirmații nejustificate ale anti-vacciniștilor, printre care:
- Nu există studii care să îi compare pe cei vaccinați cu cei nevaccinați: am arătat că există (chiar foarte multe);
- Studiile care evaluează eficiența vaccinurilor verifică doar titrul de anticorpi: am arătat că există studii care verifică eficiența practică a vaccinurilor (câți sunt protejați de infecții sau de diferite boli produse de virusuri/bacterii). De fapt, majoritatea studiilor evaluează eficiența practică. Doar la cele polivalente se optează să se verifice dacă titrul de anticorpi e la același nivel cu titrul dat de administrarea separată a vaccinurilor, iar acest lucru este justificat prin faptul că (1) vaccinurile individuale au fost evaluate practic și (2) dintre cei vaccinați sunt vulnerabili (adică neprotejați sau protejați parial) doar aceia care nu au un răspuns imun corespunzător (adică nu au un nivel suficient de ridicat de anticorpi);
- Nu există decât studii finanțate de companiile farmaceutice: cele mai multe dintre studiile pe care le-am citat nu sunt finanțate de companiile farmaceutice, iar dintre cele finanțate, cele noi sunt înregistrate pe ClinicalTrials.gov, un lucru foarte important care neutralizează cel mai important mod în care pot fi manipulate rezultatele: publication bias. În plus, există mai multe tipuri de probe care ne arată că vaccinurile sunt sigure și eficiente. Pe lângă studiile clinice există și studii observaționale care se folosesc de datele oficiale din spitale și care evaluează care a fost efectul practic al introducerii unui vaccin. Aceste studii nu sunt făcute de companiile farmaceutice (cu excepția studiilor post-marketing pe care sunt obligate să le facă). Cartea conspirației este jucată foarte bine de anti-vacciniști, folosindu-se de faptul că industria farmaceutică este coruptă, dar neînțelegând cum se aplică acest fapt la vaccinuri (cu excepția cazului oseltamivir, lucrurile sunt clare). Ar fi foarte multe de zis aici;
- Ingredientele (în special aluminiul) din vaccinuri sunt neurotoxice: afirmația poate fi demontată în două feluri, și anume (1) evaluând siguranța vaccinurilor sau (2) evaluând fiecare ingredient în parte. Eu am ales prima variantă și am arătat prin meta-analize și prin studii observaționale mari cu cât crește numărul de efecte adverse grave la cei vaccinați, comparativ cu cei nevaccinați. În comparație, anti-vacciniștii își aleg câteva studii care le convin și le menționează doar pe alea („studii făcute de niște cercetători ONEȘTI”), discreditându-le pe toate celelalte pe motiv că nu sunt perfecte (de parcă ar exista studii perfecte), uitând să spună că ale lor sunt de zeci, sute sau mii de ori mai slabe;
- „Bolile copilăriei” sunt inofensive: o afirmație demonstrabil falsă. Există statistici și studii care arată că pericolele date de aceste boli prevenibile prin vaccinare sunt mult mai mari decât pericolele de efecte adverse de la vaccinuri. De aceea în acest articol am dat exemple concrete pentru fiecare boală. Faptul că nu percepem riscul la nivel intuitiv se datorează faptului că vaccinurile au dus la scăderea impresionantă a numărului de bolnavi;
Este important de știut și că avem precedente în care vaccinurile care n-au fost suficient de eficiente sau sigure n-au fost aprobate, iar cele care inițial s-au dovedit sigure, dar ulterior s-a observat că folosirea lor produce totuși niște efecte secundare grave cu o frecvență mare, au fost retrase. Am menționat două exemple în acest articol: vaccinul ROR cu tulpina Urabe și vaccinul RotaShield. Mai sunt și altele.
Acest articol nu este pentru Piersicuța, care o să spună că studiul lui Jain et al. (2015) despre autism și ROR nu este perfect, deci nu contează (ea neînțelegând diferența dintre un studiu clinic și un studiu de cohortă) sau că recenzia sistematică făcută de Institute of Medicine (Clayton et al., 2012) face parte dintr-o mare conspirație. Acest articol este pentru cei care sunt interesați să ia o decizie informată, să cântărească riscurile și beneficiile vaccinării, folosindu-se de cele mai bune dovezi științifice disponibile. Considerați acest articol ca un punct de pornire și nu ca o sursă de informații absolute. Nu am un blog anti-vaccin să împart Adevărul™, tot ce vă pot oferi e rezultatul efortului meu de a găsi cele mai bune informații, de a contracara afirmațiile false și înșelătoare și de a mă informa la rândul meu în legătură cu ceea ce scriu. Întotdeauna există risc de erori, iar acest articol nu face excepție (în caz că exista vreun dubiu).
Recomandări:
Oxford Vaccine Group (grup independent care se ocupă cu studierea vaccinurilor): Videoclipuri scurte cu oameni care au suferit din cauza bolilor prevenibile prin vaccinuri
Archana Chatterjee – Vaccinophobia and Vaccine Controversies of the 21st Century
Despre ROR: Degrees of Clarity
Despre Andrew Wakefield: Left Brain, Right Brain
Despre encefalita produsă de pojar: Fisher et al. (2014), Measles-induced encephalitis
Despre tusea convulsivă și vaccin: CSICOP
Despre minciuni legate de tusea convulsivă: Skeptical Raptor
Despre calitatea articolelor anti-vaccin: Skeptical Raptor
Note:
1: Shepard et al. (2006); El-Serag (2011); Strayer & Rubin (2012): pg. 696-706;
2: WHO (2015a);
3: FitzSimons et al. (2005); Leuridan & Van Damme (2011); Canadian Immunisation Guide (2015);
4: Tazhibi et al. (2014);
5: Shepard et al. (2006);
6: Neff et al. (2011);
7: Sung et al. (2008);
8: Van Damme & Van Herck (2007);
9: Sangaré et al. (2009);
10: Clayton et al. (2012); Shepard et al. (2006); Maglione et al. (2014); Kuhnert et al. (2012); Zuckerman (2006);
11: DiMicheli et al. (2012);
12: Farez & Correale (2011); vezi și Ascherio et al. (2001);
13: Zuckerman (2006);
14: Niu et al. (1999);
15: Naghavi (2015);
16: Baxter, Bakshi et al. (2013);
17: WHO (2015b);
18: Seddon & Shingadia (2014);
19: Zager & McNerney (2008);
20: Didilescu et al. (2011); Ibraim et al. (2009);
21: European Centre for Disease Prevention and Control (2014a): pg. 190 (România), pg. 184 (Moldova);
22: Abubakar et al. (2013); Colditz et al. (1994); Rodriguez et al. (1993); Linchevski (2009); Roy et al. (2014);
23: Aronson et al. (2004);
24: Ahmad et al. (2013);
25: Trunz et al. (2006);
26: CDC (2011a);
27: Cuello-García et al. (2013);
28: WHO (2012); CDC (1996);
29: Krysztopa-Grzybowska (2012);
30: Chan et al. (2011);
31: Balicer et al. (2007); Farez & Correale (2011);
32: Strayer & Rubin (2012): pg. 546 (pneumonie), pg. 1195 (infecții ale urechii), pg. 1318 (meningită); CDC (2013b);
33: O’Brien et al. (2009);
34: Lucero et al. (2009);
35: Moberley et al. (2013);
36: Fortanier et al. (2014), descris mai bine într-un editorial Cochrane de Del Mar & Smith (2014);
37: Ingels et al. (2012);
38: Johnson et al. (2012);
39: Griffin et al. (2013); von Gottberg et al. (2014);
40: Poehling et al. (2006); Ladhani et al. (2013); Olarte et al. (2013); Slotved et al. (2014);
41: Strachan et al. (2013);
42: Yeh et al. (2010); Ruiz-Aragón et al. (2013); Maglione et al. (2014);
43: WHO (2007);
44: CDC(2012); Hadfield et al. (2000);
45: Naiditch & Bower (1954);
46: Wagner et al. (2012);
47: Clayton et al. (2012);
48: Tejpratap & Tiwari (2011);
49: Blencowe et al. (2010);
50: Clayton et al. (2012);
51: Romanus et al. (1987);
52: Lambert (2014);
53: Klein et al. (2013);
54: Zhang et al. (2014);
55: Thierry-Carstensen et al. (2013);
56: Barlow et al. (2014);
57: Baxter, Bartlett et al. (2013);
58: WHO (2006);
59: CDC (2011b);
60: Blencowe et al. (2010);
61: Zhang et al. (2014); Huang et al. (2010);
62: Jefferson et al. (2004);
63: Huang et al. (2010); Pruna et al. (2013);
64: Hernán et al. (2006); Farez & Correale (2011);
65: Clayton et al. (2012); Baxter, Bakshi et al. (2013);
66: Ray et al. (2011);
67: Müller-Nordhorn et al. (2015);
68: Bernsen et al. (2003);
69: Clayton et al. (2012);
70: Clayton et al. (2012); Thierry-Carstensen et al. (2013); Maglione et al. (2014);
71: Donegan et al. (2014);
72: Jackson et al. (2013);
73: Glanz et al. (2009);
74: Kidd et al. (1996); Marx et al. (2000); Atkinson et al. (2009); Strayer & Rubin (2012): pg. 1325-1326; WHO (2014);
75: Pițigoi & Crăciun (2013);
76: Grassly (2014);
77: American Academy of Pediatrics Committee on Infectious Diseases (1997);
78: Robertson et al. (1988); Meldrum (1998);
79: Cuba (2007);
80: American Academy of Pediatrics Committee on Infectious Diseases (1994); vezi și referințele citate de Cáceres & Sutter (2001) la Historical Overview; vezi și Horstmann (1991) pentru mai multe informații despre studiile masive (cu milioane de participanți) făcute în Uniunea Sovietică;
81: Hawken & Troy (2012);
82: Micromedex Detailed Drug Information for the Consumer; Kroger et al. (2011); Maglione et al. (2014);
83: Simons (2009);
84: Strebel et al. (1992); Shahmahmoodi et al. (2010);
85: Platt et al. (2014);
86: Marx et al. (2000); Băicuș et al. (2007); Băicuș (2012);
87: Băicuș (2012);
88: Peltola (2000);
89: Watt et al. (2009);
90: informații despre India: Verma et al. (2011); despre Kenya: Cowgill et al. (2006); despre Africa: Ramakrishnan et al. (2009); despre SUA: CDC (2013a);
91: Ahmed et al. (2013);
92: Obonyo & Lau (2006); Swingler et al. (2007);
93: Cowgill et al. (2006); Peltola et al. (1999);
94: Obonyo & Lau (2006); Maglione et al. (2014);
95: Eskola et al. (1990);
96: Black et al. (2006);
97: Johns & Hutter (2010);
98: Schmitt et al. (2003);
99: Plotkin et al. (2011);
100: Daley et al. (2014);
101: Bar-On et al. (2012);
102: Sun et al. (2012);
103: Li et al. (2011);
104: Steiner et al. (2010); Baldo et al. (2014); Ciarlet et al. (2009);
105: NHS: Complications of Measles; Schneider-Schaulies et al. (2003); Orenstein et al. (2004); Campbell et al. (2007); Clayton et al. (2012); Fisher et al. (2014);
106: ECDC (2014b);
107: NHS: Complications of Mumps; Galazka et al. (1999); Kanra et al. (2004); Rubin et al. (2015);
108: Masarani et al. (2006);
109: NHS: Complications of Rubella; Clayton et al. (2012); Cohen et al. (2014);
110: Demicheli et al. (2013); Dacă vreți să înțelegeți la ce se referă afirmația din sumar care spune că studiile sunt „inadecvate”, puteți ori să citiți mai mult din studiu, ori o explicație pe Left Brain, Right Brain;
111: Wang et al. (2014);
112: Elliman et al. (2009);
113: Hinman et al. (2004); Bae et al. (2013); White et al. (1985); Wichmann & Ultsch (2013); Babigumira et al. (2013);
114: Mantadakis et al. (2010); O’Leary et al. (2012);
115: Clayton et al. (2012); Maglione et al. (2014); Bohlke et al. (2003); Campbell et al. (2007); Fritsche et al. (2010); Farez & Correale (2011); Baxter et al. (2013);
116: Wakefield et al. (1998); Editors of The Lancet (2010);
117: Biss (2014): pg. 69; Allan & Ivers (2010);
118: Deer (2011);
119: Allan & Ivers (2010); Immunize.org; Hornig et al. (2008);
120: Patja et al. (2000);
121: DeStefano (2001);
122: Christie (2002);
123: Wilson et al. (2003);
124: Chen et al. (2004);
125: Honda et al. (2005);
126: Doja & Roberts (2006); Fombonne et al. (2006);
127: Hertz-Picciotto et al. (2010);
128: Demicheli et al. (2013); Clayton et al. (2012);
129: DeStefano et al. (2013);
130: Taylor et al. (2014);
131: Jain et al. (2015);
132: Parashar et al. (2006); Bilcke et al. (2009); Chandran et al. (2010); Lin et al. (2014);
133: Richardson et al. (2010); Gastañaduy et al. (2013);
134: do Carmo et al. (2011); Lanzieri et al. (2010);
135: Yen et al. (2011);
136: Bayard et al. (2012);
137: Curns et al. (2010);
138: Tate et al. (2011);
139: Lambert et al. (2009);
140: Zeller et al. (2010);
141: Karafillakis et al. (2015);
142: Ruiz-Palacios et al. (2006);
143: Soares-Weiser et al. (2012);
144: Soares-Weiser (2012);
145: Maglione et al. (2014);
146: Yih et al. (2014);
147: Buttery et al. (2011);
148: Velázquez et al. (2012);
149: Shui et al. (2012);
150: Peter & Myers (2002);
151: Jiang et al. (2013); Takeuchi et al. (2012);
152: Parashar et al. (2000); Muhsen et al. (2014); Samad et al. (2013);
153: Desai et al. (2013);
154: Clark et al. (2014);
155: Desai et al. (2012);
156: Kollaritsch et al. (2015);
157: Derry & Loke (2000); McQuaid & Laine (2006); Kwok & Loke (2010);
158: Cupp (1999);
159: Gabardi et al. (2007);
160: Posadzki, Alotaibi & Ernst (2012); Chirumbolo (2014);
161: printre altele: Niggemann & Grüber (2003); Aronson (2009); Wikipedia: List of herbs with known adverse effects;
162: Recomandări ale sistemului GRADE: Guyatt et al. (2011); Calitatea studiilor observaționale: Concato et al. (2000); Vezi și referințele din introducerea articolului Hung et al. (2015);
Referințe:
Abubakar, I., Pimpin, L., Ariti, C., Beynon, R., Mangtani, P., Sterne, J., … & Rodrigues, L. (2013). Systematic review and meta-analysis of the current evidence on the duration of protection by bacillus Calmette-Guérin vaccination against tuberculosis. Health Technol Assess, 17(37), 1-372.
Ahmad NA, Abd Hamid HA, Sahril N, Mohd Yusoff MF, Naidu BM, et al. (2013) Bacille Calmette-Guérin (BCG) Revaccination: Is it Beneficial for Tuberculosis Control? 2:656 doi:10.4172/scientificreports.656
Ahmed, A. N. U., Khan, N. Z., Hussain, M., Amin, M. R., Hanif, M., Mahbub, M., … & Saha, S. K. (2013). Follow-up of cases of Haemophilus influenzae type b meningitis to determine its long-term sequelae. The Journal of pediatrics, 163(1), S44-S49. (Abstract)
Allan, G. M., & Ivers, N. (2010). The autism-vaccine story: fiction and deception? Canadian Family Physician, 56(10), 1013.
American Academy of Pediatrics Committee on Infectious Diseases (1994) Administration of the third dose of oral poliomyelitis vaccine at 6 to 18 months of age. Pediatrics. 94:774–775.
American Academy of Pediatrics Committee on Infectious Diseases. (1997). Poliomyelitis prevention: recommendations for use of inactivated and live oral poliovirus vaccines. Pediatrics, 99, 300-5.
Aronson, J. K. (Ed.). (2009). Meyler’s side effects of herbal medicines. Elsevier. (Google Books)
Aronson, N. E., Santosham, M., Comstock, G. W., Howard, R. S., Moulton, L. H., Rhoades, E. R., & Harrison, L. H. (2004). Long-term efficacy of BCG vaccine in American Indians and Alaska Natives: a 60-year follow-up study. Jama, 291(17), 2086-2091.
Ascherio, A., Zhang, S. M., Hernán, M. A., Olek, M. J., Coplan, P. M., Brodovicz, K., & Walker, A. M. (2001). Hepatitis B vaccination and the risk of multiple sclerosis. New England Journal of Medicine, 344(5), 327-332.
Atkinson W, Hamborsky J, McIntyre L, Wolfe S (eds.) (2009). „Poliomyelitis„. Epidemiology and Prevention of Vaccine-Preventable Diseases (The Pink Book) (11th ed.). Washington DC: Public Health Foundation. pp. 231–44.
Babigumira, J. B., Morgan, I., & Levin, A. (2013). Health economics of rubella: a systematic review to assess the value of rubella vaccination. BMC Public Health, 13, 406. doi:10.1186/1471-2458-13-406
Bae, G. R., Choe, Y. J., Go, U. Y., Kim, Y. I., & Lee, J. K. (2013). Economic analysis of measles elimination program in the Republic of Korea, 2001: a cost benefit analysis study. Vaccine, 31(24), 2661-2666.
Băicuș, A., Persu, A., Combiescu, M., & Aubert-Combiescu, A. (2007). The maintaining of the active laboratory-based surveillance of the acute flaccid paralysis (AFP) cases in Romania in the framework of the strategic plan of the global polio eradication initiative. Rom Arch Microbiol Immunol, 66(1-2), 44-50.
Băicuș, A. (2012). History of polio vaccination. World Journal of Virology, 1(4), 108–114. doi:10.5501/wjv.v1.i4.108
Baldo, V., Bonanni, P., Castro, M., Gabutti, G., Franco, E., Marchetti, F., … & Vitale, F. (2014). Combined hexavalent diphtheria-tetanus-acellular pertussis-hepatitis B-inactivated poliovirus-Haemophilus influenzae type b vaccine; Infanrix™ hexa: Twelve years of experience in Italy. Human vaccines & immunotherapeutics, 10(1), 129-137.
Balicer, R. D., Grotto, I., Mimouni, M., & Mimouni, D. (2007). Is childhood vaccination associated with asthma? A meta-analysis of observational studies. Pediatrics, 120(5), e1269-e1277.
Bar-On, E. S., Goldberg, E., Hellmann, S., & Leibovici, L. (2012). Combined DTP-HBV-HIB vaccine versus separately administered DTP-HBV and HIB vaccines for primary prevention of diphtheria, tetanus, pertussis, hepatitis B and Haemophilus influenzae B (HIB). The Cochrane Library.
Barlow, R. S., Reynolds, L. E., Cieslak, P. R., & Sullivan, A. D. (2014). Vaccinated children and adolescents with pertussis infections experience reduced illness severity and duration, Oregon, 2010–2012. Clinical Infectious Diseases, 58(11), 1523-1529. (Abstract)
Baxter, R., Bartlett, J., Rowhani-Rahbar, A., Fireman, B., & Klein, N. P. (2013). Effectiveness of pertussis vaccines for adolescents and adults: case-control study. BMJ, 347.
Baxter, R., Bakshi, N., Fireman, B., Lewis, E., Ray, P., Vellozzi, C., & Klein, N. P. (2013). Lack of association of Guillain-Barré syndrome with vaccinations. Clinical infectious diseases, 57(2), 197-204.
Bayard, V., DeAntonio, R., Contreras, R., Tinajero, O., Castrejon, M. M., Ortega-Barría, E., & Colindres, R. E. (2012). Impact of rotavirus vaccination on childhood gastroenteritis-related mortality and hospital discharges in Panama. International Journal of Infectious Diseases, 16(2), e94-e98.
Bernsen, R., de Jongste, J., & van der Wouden, H. (2003). Lower risk of atopic disorders in whole cell pertussis-vaccinated children. The European respiratory journal.
Bilcke, J., Van Damme, P., Van Ranst, M., Hens, N., Aerts, M., & Beutels, P. (2009). Estimating the incidence of symptomatic rotavirus infections: a systematic review and meta-analysis. PloS one, 4(6), e6060.
Biss, E. (2014). On Immunity: An Inoculation. Graywolf Press. (Google Books)
Black, S. B., Cimino, C. O., Hansen, J., Lewis, E., Ray, P., Corsaro, B., Graepel, J. & Laufer, D. (2006). Immunogenicity and safety of measles-mumps-rubella, varicella and Haemophilus influenzae type b vaccines administered concurrently with a fourth dose of heptavalent pneumococcal conjugate vaccine compared with the vaccines administered without heptavalent pneumococcal conjugate vaccine. The Pediatric infectious disease journal, 25(4), 306-311. (Abstract)
Blencowe, H., Lawn, J., Vandelaer, J., Roper, M., & Cousens, S. (2010). Tetanus toxoid immunization to reduce mortality from neonatal tetanus. International Journal of Epidemiology, 39(Suppl 1), i102–i109. doi:10.1093/ije/dyq027
Bohlke, K., Davis, R. L., Marcy, S. M., Braun, M. M., DeStefano, F., Black, S. B., … & Thompson, R. S. (2003). Risk of anaphylaxis after vaccination of children and adolescents. Pediatrics, 112(4), 815-820.
Buttery, J. P., Danchin, M. H., Lee, K. J., Carlin, J. B., McIntyre, P. B., Elliott, E. J., … & PAEDS/APSU Study Group. (2011). Intussusception following rotavirus vaccine administration: post-marketing surveillance in the National Immunization Program in Australia. Vaccine, 29(16), 3061-3066.
Cáceres, V. M., & Sutter, R. W. (2001). Sabin monovalent oral polio vaccines: review of past experiences and their potential use after polio eradication. Clinical infectious diseases, 33(4), 531-541.
Campbell, H., Andrews, N., Brown, K. E., & Miller, E. (2007). Review of the effect of measles vaccination on the epidemiology of SSPE. International journal of epidemiology, 36(6), 1334-1348.
Canadian Immunisation Guide. Part 4: Active Vaccines – Hepatits B Vaccine. Public Health Agency of Canada [Last updated: 2015]
Centers for Disease Control and Prevention (CDC) (1996). The role of BCG vaccine in the prevention and control of tuberculosis in the United States: a joint statement by the Advisory Council for the Elimination of Tuberculosis and the Advisory Committee on Immunization Practices. US Department of Health and Human Services, Public Health Service, Centers for Disease Control and Prevention (CDC), Epidemiology Program Office.
Centers for Disease Control and Prevention (2011a). „Fact Sheets: BCG Vaccine„.
Centers for Disease Control and Prevention (2011b). „Tetanus„. Epidemiology and Prevention of Vaccine-Preventable Diseases. Washington, D.C: Public Health Foundation. ISBN 0-01-706609-3.
Centers for Disease Control and Prevention (2012). Epidemiology, C. D. C. Prevention of Vaccine-Preventable Diseases. The Pink Book: Course Textbook-Second Printing. Chapter 16. Diphtheria.
Centers for Disease Control and Prevention (2013a). Haemophilus Influenzae.
Centers for Disease Control and Prevention (2013b). Pneumococcal Disease.
Chan, W. M., Kwan, Y. W., & Leung, C. W. (2011). Management of Bacillus Calmette-Guérin Lymphadenitis 卡介苗淋巴腺炎的處理. HK J Paediatr (new series), 16(2), 85-94.
Chandran, A., Fitzwater, S., Zhen, A., & Santosham, M. (2010). Prevention of rotavirus gastroenteritis in infants and children: rotavirus vaccine safety, efficacy, and potential impact of vaccines. Biologics : Targets & Therapy, 4, 213–229.
Chen, W., Landau, S., Sham, P., & Fombonne, E. (2004). No evidence for links between autism, MMR and measles virus. Psychological medicine, 34(03), 543-553. (Abstract)
Chirumbolo, S. (2014). Adverse effects and homeopathy: may remedies yet contain noxious or toxic molecules?. British journal of clinical pharmacology, 78(1), 184-185.
Christie, B. (2002). Scottish expert group finds no link between MMR and autism. BMJ : British Medical Journal, 324(7346), 1118.
Ciarlet, M., He, S., Lai, S., Petrecz, M., Yuan, G., Liu, G. F., Mikviman, E., Heaton, P. M., Panzer, F., Rose, T., Koller, D. Y., Van Damme, P. & Schödel, F. (2009). Concomitant use of the 3-dose oral pentavalent rotavirus vaccine with a 3-dose primary vaccination course of a diphtheria-tetanus-acellular pertussis-hepatitis B-inactivated polio-Haemophilus influenzae type b vaccine: immunogenicity and reactogenicity. The Pediatric infectious disease journal, 28(3), 177-181. (Abstract)
Clark, A., Jit, M., Andrews, N., Atchison, C., Edmunds, W. J., & Sanderson, C. (2014). Evaluating the potential risks and benefits of infant rotavirus vaccination in England. Vaccine, 32(29), 3604-3610.
Clayton, E. W., Rusch, E., Ford, A., & Stratton, K. (Eds.). (2012). Adverse Effects of Vaccines: Evidence and Causality. National Academies Press. [PDF]
Cohen, B. E., Durstenfeld, A., & Roehm, P. C. (2014). Viral Causes of Hearing Loss: A Review for Hearing Health Professionals. Trends in Hearing, 18, 2331216514541361. doi:10.1177/2331216514541361
Colditz, G. A., Brewer, T. F., Berkey, C. S., Wilson, M. E., Burdick, E., Fineberg, H. V., & Mosteller, F. (1994). Efficacy of BCG vaccine in the prevention of tuberculosis: meta-analysis of the published literature. JAMA, 271(9), 698-702. (Abstract)
Concato, J., Shah, N., & Horwitz, R. I. (2000). RANDOMIZED, CONTROLLED TRIALS, OBSERVATIONAL STUDIES, AND THE HIERARCHY OF RESEARCH DESIGNS. The New England Journal of Medicine, 342(25), 1887–1892.
Cowgill, K. D., Ndiritu, M., Nyiro, J., Slack, M. P. E., Chiphatsi, S., Ismail, A., … Scott, J. A. G. (2006). Effectiveness of Haemophilus influenzae type b conjugate vaccine introduction into routine childhood immunization in Kenya. JAMA : The Journal of the American Medical Association, 296(6), 671–678. doi:10.1001/jama.296.6.671
Cuba, I. P. V. (2007). Randomized, placebo-controlled trial of inactivated poliovirus vaccine in Cuba. The New England journal of medicine, 356(15), 1536.
Cuello-García, C. A., Pérez-Gaxiola, G., & Jiménez Gutiérrez, C. (2013). Treating BCG-induced disease in children. The Cochrane Library.
Cupp MJ (1999). Herbal remedies: adverse effects and drug interactions. Am Fam Physician. 1999 Mar 1;59(5):1239-1244.
Curns, A. T., Steiner, C. A., Barrett, M., Hunter, K., Wilson, E., & Parashar, U. D. (2010). Reduction in acute gastroenteritis hospitalizations among US children after introduction of rotavirus vaccine: analysis of hospital discharge data from 18 US states. Journal of Infectious Diseases, 201(11), 1617-1624.
Daley, M. F., Yih, W. K., Glanz, J. M., Hambidge, S. J., Narwaney, K. J., Yin, R., … & Weintraub, E. (2014). Safety of diphtheria, tetanus, acellular pertussis and inactivated poliovirus (DTaP–IPV) vaccine. Vaccine, 32(25), 3019-3024.
Deer, B. (2011). How the case against the MMR vaccine was fixed. BMJ, 342.
Del Mar, Chris & Smith, Jane. Preventing otitis media with pneumococcal conjugate vaccine: more data than certainty?[editorial]. Cochrane Database of Systematic Reviews 2014;(): 10.1002/14651858.ED000082
Demicheli, V., Rivetti, A., Debalini, M. G., & Di Pietrantonj, C. (2013). Vaccines for measles, mumps and rubella in children. Evidence-Based Child Health: A Cochrane Review Journal, 8(6), 2076-2238.
Derry, S., & Loke, Y. K. (2000). Risk of gastrointestinal haemorrhage with long term use of aspirin: meta-analysis. BMJ : British Medical Journal, 321(7270), 1183–1187.
Desai R, Parashar UD, Lopman B, de Oliveira LH, Clark AD, Sanderson CF, Tate JE, Matus CR, Andrus JK, Patel MM. (2012). Potential intussusception risk versus health benefits from rotavirus vaccination in Latin America. Clin Infect Dis; 54(10):1397-405. doi: 10.1093/cid/cis191.
Desai, R., Cortese, M. M., Meltzer, M. I., Shankar, M., Tate, J. E., Yen, C., … & Parashar, U. D. (2013). Potential intussusception risk versus benefits of rotavirus vaccination in the United States. The Pediatric infectious disease journal, 32(1), 1-7.
DeStefano, F. (2001). MMR vaccine and autism: a review of the evidence for a causal association. Molecular psychiatry, 7, S51-2.
DeStefano, F., Price, C. S., & Weintraub, E. S. (2013). Increasing exposure to antibody-stimulating proteins and polysaccharides in vaccines is not associated with risk of autism. The Journal of pediatrics, 163(2), 561-567.
Didilescu, C., Popescu, G., Cioran, N., & Cocei, H. (2011). [Mortality of tuberculosis in Romania, a marker for severity of the endemic]. Pneumologia (Bucharest, Romania), 61(3), 150-152. (Abstract)
DiMiceli, L., Pool, V., Kelso, J. M., Shadomy, S. V., Iskander, J., & VAERS Team. (2006). Vaccination of yeast sensitive individuals: review of safety data in the US vaccine adverse event reporting system (VAERS). Vaccine, 24(6), 703-707. (Abstract)
do Carmo GMI, Yen C, Cortes J, Siqueira AA, de Oliveira WK, et al. (2011) Decline in Diarrhea Mortality and Admissions after Routine Childhood Rotavirus Immunization in Brazil: A Time-Series Analysis. PLoS Med 8(4): e1001024. doi:10.1371/journal.pmed.1001024
Doja, A., & Roberts, W. (2006). Immunizations and autism: a review of the literature. The Canadian Journal of Neurological Sciences, 33(04), 341-346. (Abstract)
Donegan, K., King, B., & Bryan, P. (2014). Safety of pertussis vaccination in pregnant women in UK: observational study. BMJ, 349, g4219.
Editors of The Lancet (2010). Retraction—Ileal-lymphoid-nodular hyperplasia, non-specific colitis, and pervasive developmental disorder in children. The Lancet, Volume 375, Issue 9713, 6–12, Page 445 (Abstract)
El-Serag HB (2011). Hepatocellular carcinoma. N Engl J Med;365:1118–1127. [Traducere]
Elliman, D., Sengupta, N., El Bashir, H., & Bedford, H. (2009). Measles, mumps, and rubella: prevention. BMJ Clinical Evidence, 2009, 0316.
Eskola, J., Käyhty, H., Takala, A. K., Peltola, H., Rönnberg, P. R., Kela, E., … & Mäkelä, P. H. (1990). A randomized, prospective field trial of a conjugate vaccine in the protection of infants and young children against invasive Haemophilus influenzae type b disease. New England Journal of Medicine, 323(20), 1381-1387.
European Centre for Disease Prevention and Control/WHO Regional Office for Europe (2014a). Tuberculosis surveillance and monitoring in Europe 2014. Stockholm: European Centre for Disease Prevention and Control.
European Centre for Disease Prevention and Control (2014b). Measles and rubella monitoring, February 2014 – Reporting on January–December 2013 surveillance data and epidemic intelligence data to the end of February 2014. Stockholm: ECDC.
Farez, M. F., & Correale, J. (2011). Immunizations and risk of multiple sclerosis: systematic review and meta-analysis. Journal of neurology, 258(7), 1197-1206.
Fisher, D. L., Defres, S., & Solomon, T. (2014). Measles-induced encephalitis. QJM, hcu113.
FitzSimons, D., François, G., Hall, A., McMahon, B., Meheus, A., Zanetti, A., … & Van Damme, P. (2005). Long-term efficacy of hepatitis B vaccine, booster policy, and impact of hepatitis B virus mutants. Vaccine, 23(32), 4158-4166.
Fombonne, E., Zakarian, R., Bennett, A., Meng, L., & McLean-Heywood, D. (2006). Pervasive developmental disorders in Montreal, Quebec, Canada: prevalence and links with immunizations. Pediatrics, 118(1), e139-e150.
Fortanier AC, Venekamp RP, Boonacker CWB, Hak E, Schilder AGM, Sanders EAM, et al. Pneumococcal conjugate vaccines for preventing otitis media. Cochrane Database of Systematic Reviews 2014;(3):CD001480. dx.doi.org/10.1002/14651858.CD001480.pub4
Fritsche, P. J., Helbling, A., & Ballmer-Weber, B. K. (2010). Vaccine hypersensitivity–update and overview. Swiss Med Wkly, 140(17-18), 238-46.
Gabardi, S., Munz, K., & Ulbricht, C. (2007). A Review of Dietary Supplement–Induced Renal Dysfunction. Clinical Journal of the American Society of Nephrology, 2(4), 757-765.
Galazka, A. M., Robertson, S. E., & Kraigher, A. (1999). Mumps and mumps vaccine: a global review. Bulletin of the World Health Organization, 77(1), 3.
Gastañaduy, P. A., Sánchez-Uribe, E., Esparza-Aguilar, M., Desai, R., Parashar, U. D., Patel, M., & Richardson, V. (2013). Effect of rotavirus vaccine on diarrhea mortality in different socioeconomic regions of Mexico. Pediatrics, 131(4), e1115-e1120.
Glanz, J. M., McClure, D. L., Magid, D. J., Daley, M. F., France, E. K., Salmon, D. A., & Hambidge, S. J. (2009). Parental refusal of pertussis vaccination is associated with an increased risk of pertussis infection in children. Pediatrics, 123(6), 1446-1451.
Grassly, N. C. (2014). Immunogenicity and effectiveness of routine immunization with 1 or 2 doses of inactivated poliovirus vaccine: systematic review and meta-analysis. Journal of Infectious Diseases, 210(suppl 1), S439-S446.
Griffin MR, Zhu Y, Moore MR, Whitney CG, Grijalva CG. U.S. Hospitalizations for Pneumonia after a Decade of Pneumococcal Vaccination. N Engl J Med 2013;369:155-63. DOI: 10.1056/NEJMoa1209165.
Guyatt, G., Oxman, A. D., Akl, E. A., Kunz, R., Vist, G., Brozek, J., … & Schünemann, H. J. (2011). GRADE guidelines: 1. Introduction—GRADE evidence profiles and summary of findings tables. Journal of clinical epidemiology, 64(4), 383-394.
Hadfield, T. L., McEvoy, P., Polotsky, Y., Tzinserling, V. A., & Yakovlev, A. A. (2000). The pathology of diphtheria. Journal of Infectious Diseases, 181(Supplement 1), S116-S120.
Hawken, J., & Troy, S. B. (2012). Adjuvants and Inactivated Polio Vaccine: A Systematic Review. Vaccine, 30(49), 6971–6979. doi:10.1016/j.vaccine.2012.09.059
Hernán, M. A., Alonso, A., & Hernández-Díaz, S. (2006). Tetanus vaccination and risk of multiple sclerosis: A systematic review. Neurology, 67(2), 212-215. (Abstract)
Hertz-Picciotto, I., Green, P. G., Delwiche, L., Hansen, R., Walker, C., & Pessah, I. N. (2010). Blood Mercury Concentrations in CHARGE Study Children with and without Autism. Environmental Health Perspectives, 118(1), 161–166. doi:10.1289/ehp.0900736
Hinman, A. R., Zhou, F., Reef, S., Massoudi, M., Papania, M. J., Yusuf, H. R., … & McCauley, M. M. (2004). An economic analysis of the current universal 2-dose measles-mumps-rubella vaccination program in the United States. Journal of Infectious Diseases, 189(Supplement 1), S131-S145.
Honda, H., Shimizu, Y. and Rutter, M. (2005), No effect of MMR withdrawal on the incidence of autism: a total population study. Journal of Child Psychology and Psychiatry, 46: 572–579. doi: 10.1111/j.1469-7610.2005.01425.x
Hornig, M., Briese, T., Buie, T., Bauman, M. L., Lauwers, G., Siemetzki, U., … Lipkin, W. I. (2008). Lack of Association between Measles Virus Vaccine and Autism with Enteropathy: A Case-Control Study. PLoS ONE, 3(9), e3140. doi:10.1371/journal.pone.0003140
Horstmann, D. M. (1991). The Sabin live poliovirus vaccination trials in the USSR, 1959. The Yale Journal of Biology and Medicine, 64(5), 499–512.
Huang, W. T., Gargiullo, P. M., Broder, K. R., Weintraub, E. S., Iskander, J. K., Klein, N. P., & Baggs, J. M. (2010). Lack of association between acellular pertussis vaccine and seizures in early childhood. Pediatrics, 126(2), 263-269.
Hung BT, Long NP, Hung LP, Luan NT, Anh NH, et al. (2015) Research Trends in Evidence-Based Medicine: A Joinpoint Regression Analysis of More than 50 Years of Publication Data. PLoS ONE 10(4): e0121054. doi:10.1371/journal.pone.0121054
Ibraim, E., Stoicescu, I. P., Homorodean, D., Popa, C., Burecu, M., Stoicescu, I., … & Andrei, M. (2009). [Tuberculosis in Romania. Problems and solutions]. Pneumologia (Bucharest, Romania), 59(1), 6-12. (Abstract)
Ingels, H., Rasmussen, J., Andersen, P. H., Harboe, Z. B., Glismann, S., Konradsen, H., … & Lambertsen, L. (2012). Impact of pneumococcal vaccination in Denmark during the first 3 years after PCV introduction in the childhood immunization programme. Vaccine, 30(26), 3944-3950. (Abstract)
Jackson, L. A., Peterson, D., Nelson, J. C., Marcy, S. M., Naleway, A. L., Nordin, J. D., … & Weintraub, E. (2013). Vaccination site and risk of local reactions in children 1 through 6 years of age. Pediatrics, 131(2), 283-289.
Jain A, Marshall J, Buikema A, Bancroft T, Kelly JP, Newschaffer CJ (2015). Autism Occurrence by MMR Vaccine Status Among US Children With Older Siblings With and Without Autism. JAMA. 313(15):1534-1540. doi:10.1001/jama.2015.3077.
Jefferson, T., Rudin, M., & Di Pietrantonj, C. (2004). Adverse events after immunisation with aluminium-containing DTP vaccines: systematic review of the evidence. The Lancet infectious diseases, 4(2), 84-90.
Jiang, J., Jiang, B., Parashar, U., Nguyen, T., Bines, J., & Patel, M. M. (2013). Childhood Intussusception: A Literature Review. PLoS ONE, 8(7), e68482. doi:10.1371/journal.pone.0068482
Johns, T. L., & Hutter, G. E. (2010). New combination vaccines: DTaP-IPV (Kinrix) and DTaP-IPV/Hib (Pentacel). Annals of Pharmacotherapy, 44(3), 515-523. (Abstract)
Johnson, D. R., D’Onise, K., Holland, R. A., Raupach, J. C., & Koehler, A. P. (2012). Pneumococcal disease in South Australia: vaccine success but no time for complacency. Vaccine, 30(12), 2206-2211. (Abstract)
Kanra, G., Isik, P., Kara, A., Cengiz, A. B., Seçmeer, G. and Ceyhan, M. (2004), Complementary findings in clinical and epidemiologic features of mumps and mumps meningoencephalitis in children without mumps vaccination. Pediatrics International, 46: 663–668. doi: 10.1111/j.1442-200x.2004.01968.x (Abstract)
Karafillakis, E., Hassounah, S., & Atchison, C. (2015). Effectiveness and impact of rotavirus vaccines in Europe, 2006–2014. Vaccine, 33(18), 2097-2107.
Kidd, D., Williams, A. J., & Howard, R. S. (1996). Poliomyelitis. Postgraduate Medical Journal, 72(853), 641–647.
Klein, N. P., Bartlett, J., Fireman, B., Rowhani-Rahbar, A., & Baxter, R. (2013). Comparative effectiveness of acellular versus whole-cell pertussis vaccines in teenagers. Pediatrics, 131(6), e1716-e1722.
Kollaritsch, H., Kundi, M., Giaquinto, C., & Paulke-Korinek, M. (2015). Rotavirus vaccines: a Story of Success. Clinical Microbiology and Infection. (Abstract)
Kroger, A. T., Sumaya, C. V., Pickering, L. K., & Atkinson, W. L. (2011). Centers of Disease Control and Prevention. General Recommendations on immunization: recommendations of the Advisory Committee on Immunization Practices (ACIP).
Krysztopa-Grzybowska, K., Paradowska-Stankiewicz, I., & Lutyńska, A. (2012). The Rate of Adverse Events Following BCG Vaccination in Poland. Przegląd Epidemiologiczny, 66, 465-469.
Kuhnert, R., Schlaud, M., Poethko-Müller, C., Vennemann, M., Fleming, P., Blair, P. S., Mitchell, E., Thompson, J. & Hecker, H. (2012). Reanalyses of case-control studies examining the temporal association between sudden infant death syndrome and vaccination. Vaccine, 30(13), 2349-2356.
Kwok, C. S., & Loke, Y. K. (2010). Critical Overview on the Benefits and Harms of Aspirin. Pharmaceuticals, 3(5), 1491-1506.
Ladhani, S. N., Andrews, N. J., Waight, P., Borrow, R., Slack, M. P., & Miller, E. (2013). Impact of the 7-valent pneumococcal conjugate vaccine on invasive pneumococcal disease in infants younger than 90 days in England and Wales. Clinical infectious diseases, 56(5), 633-640.
Lambert, S. B., Faux, C. E., Hall, L., Birrell, F. A., Peterson, K. V., Selvey, C. E., … & Grimwood, K. (2009). Early evidence for direct and indirect effects of the infant rotavirus vaccine program in Queensland. Med J Aust, 191(3), 157-160.
Lambert, L. C. (2014). Pertussis Vaccine Trials in the 1990s. The Journal of Infectious Diseases, 209(Suppl 1), S4–S9. doi:10.1093/infdis/jit592
Lanzieri, T. M., Costa, I., Shafi, F. A., Cunha, M. H., Ortega-Barria, E., Linhares, A. C., & Colindres, R. E. (2010). Trends in hospitalizations from all-cause gastroenteritis in children younger than 5 years of age in Brazil before and after human rotavirus vaccine introduction, 1998–2007. The Pediatric infectious disease journal, 29(7), 673-675. (Abstract)
Leuridan, E., & Van Damme, P. (2011). Hepatitis B and the need for a booster dose. Clinical infectious diseases, 53(1), 68-75.
Li, R. C., Li, F. X., Li, Y. P., Hou, Q. M., Li, C. G., Li, Y. N., … & Ortiz, E. (2011). Immunogenicity and safety of a pentavalent acellular pertussis combined vaccine including diphtheria, tetanus, inactivated poliovirus and conjugated Haemophilus Influenzae type b polysaccharide for primary vaccination at 2, 3, 4 or 3, 4, 5 months of age in infants in China. Vaccine, 29(10), 1913-1920. ClinicalTrials.gov identifier: NCT00453570 (Abstract)
Lin, C.-L., Chen, S.-C., Liu, S.-Y., & Chen, K.-T. (2014). Disease Caused by Rotavirus Infection. The Open Virology Journal, 8, 14–19. doi:10.2174/1874357901408010014
Linchevski, I., Klmenet, E., & Nir-Paz, R. (2009). Mycoplasma pneumoniae vaccine protective efficacy and adverse reactions—systematic review and meta-analysis. Vaccine, 27(18), 2437-2446.
Lucero, M. G., Dulalia, V. E., Nillos, L. T., Williams, G., Parreño, R. A. N., Nohynek, H., Riley, I. D. & Makela, H. (2009). Pneumococcal conjugate vaccines for preventing vaccine‐type invasive pneumococcal disease and X‐ray defined pneumonia in children less than two years of age. The Cochrane Library. (Abstract)
Maglione, M. A., Das, L., Raaen, L., Smith, A., Chari, R., Newberry, S., … & Gidengil, C. (2014). Safety of vaccines used for routine immunization of US children: a systematic review. Pediatrics, 134(2), 325-337. [Întreg raportul de peste 700 pagini este aici]
Mantadakis, E., Farmaki, E., & Buchanan, G. R. (2010). Thrombocytopenic purpura after measles-mumps-rubella vaccination: a systematic review of the literature and guidance for management. The Journal of pediatrics, 156(4), 623-628.
Marx, A., Glass, J. D., & Sutter, R. W. (2000). Differential diagnosis of acute flaccid paralysis and its role in poliomyelitis surveillance. Epidemiologic reviews, 22(2), 298-316.
Masarani, M., Wazait, H., & Dinneen, M. (2006). Mumps orchitis. Journal of the Royal Society of Medicine, 99(11), 573–575.
McQuaid, K. R., & Laine, L. (2006). Systematic review and meta-analysis of adverse events of low-dose aspirin and clopidogrel in randomized controlled trials. The American journal of medicine, 119(8), 624-638.
Meldrum, M. (1998). “A calculated risk”: the Salk polio vaccine field trials of 1954. BMJ : British Medical Journal, 317(7167), 1233–1236.
Micromedex Detailed Drug Information for the Consumer [Internet]. Poliovirus Vaccine, Inactivated (Injection route). March 1, 2015.
Moberley S, Holden J, Tatham DP, Andrews RM. Vaccines for preventing pneumococcal infection in adults. Cochrane Database of Systematic Reviews 2013, Issue 1. Art. No.: CD000422. DOI: 10.1002/14651858.CD000422.pub3.
Muhsen, K., Kassem, E., Efraim, S., Goren, S., Cohen, D., & Ephros, M. (2014). Incidence and risk factors for intussusception among children in northern Israel from 1992 to 2009: a retrospective study. BMC Pediatrics, 14, 218. doi:10.1186/1471-2431-14-218
Müller-Nordhorn, J., Hettler-Chen, C.-M., Keil, T., & Muckelbauer, R. (2015). Association between sudden infant death syndrome and diphtheria-tetanus-pertussis immunisation: an ecological study. BMC Pediatrics, 15(1), 1. doi:10.1186/s12887-015-0318-7
Naghavi, M., Wang, H., Lozano, R., Davis, A., Liang, X., Zhou, M., … & Murray, C. J. (2015). Global, regional, and national age–sex specific all-cause and cause-specific mortality for 240 causes of death, 1990–2013: a systematic analysis for the Global Burden of Disease Study 2013. The Lancet, 385(9963), 117-171.
Naiditch, M. J., & Bower, A. G. (1954). Diphtheria: a study of 1,433 cases observed during a ten-year period at the Los Angeles County Hospital. The American journal of medicine, 17(2), 229-245. (Abstract)
Neff, G. W., Duncan, C. W., & Schiff, E. R. (2011). The Current Economic Burden of Cirrhosis. Gastroenterology & Hepatology, 7(10), 661–671.
Niggemann, B. and Grüber, C. (2003). Side-effects of complementary and alternative medicine. Allergy, 58: 707–716. doi: 10.1034/j.1398-9995.2003.00219.x (Abstract)
Niu, M. T., Salive, M. E., & Ellenberg, S. S. (1999). Neonatal deaths after hepatitis B vaccine: the vaccine adverse event reporting system, 1991-1998. Archives of pediatrics & adolescent medicine, 153(12), 1279-1282.
O’Brien, K. L., Wolfson, L. J., Watt, J. P., Henkle, E., Deloria-Knoll, M., McCall, N., … & Cherian, T. (2009). Burden of disease caused by Streptococcus pneumoniae in children younger than 5 years: global estimates. The Lancet, 374(9693), 893-902.
O’Leary, S. T., Glanz, J. M., McClure, D. L., Akhtar, A., Daley, M. F., Nakasato, C., … & Ball, R. (2012). The risk of immune thrombocytopenic purpura after vaccination in children and adolescents. Pediatrics, 129(2), 248-255.
Obonyo, C. O., & Lau, J. (2006). Efficacy of Haemophilus influenzae type b vaccination of children: a meta-analysis. European Journal of Clinical Microbiology and Infectious Diseases, 25(2), 90-97.
Olarte, L., Ampofo, K., Stockmann, C., Mason, E. O., Daly, J. A., Pavia, A. T., & Byington, C. L. (2013). Invasive Pneumococcal Disease in Infants Younger Than 90 Days Before and After Introduction of PCV7. Pediatrics, 132(1), e17–e24. doi:10.1542/peds.2012-3900
Orenstein, W. A., Perry, R. T., & Halsey, N. A. (2004). The clinical significance of measles: a review. Journal of Infectious Diseases, 189(Supplement 1), S4-S16.
Parashar, U. D., Holman, R. C., Cummings, K. C., Staggs, N. W., Curns, A. T., Zimmerman, C. M., … & Glass, R. I. (2000). Trends in intussusception-associated hospitalizations and deaths among US infants. Pediatrics, 106(6), 1413-1421. (Abstract)
Parashar, U. D., Gibson, C. J., Bresee, J. S., & Glass, R. I. (2006). Rotavirus and Severe Childhood Diarrhea. Emerging Infectious Diseases, 12(2), 304–306. doi:10.3201/eid1202.050006
Patel, M. M., Parashar, U. D., Santosham, M., & Richardson, V. (2012). The rotavirus experience in Mexico: discovery to control. Clinical infectious diseases, cis939.
Patja, A., Davidkin, I., Kurki, T., Kallio, M. J., Valle, M., & Peltola, H. (2000). Serious adverse events after measles-mumps-rubella vaccination during a fourteen-year prospective follow-up. The Pediatric infectious disease journal, 19(12), 1127-1134.
Peltola, H., Aavitsland, P., Hansen, K. G., Jónsdóttir, K. E., Nøkleby, H., & Romanus, V. (1999). Perspective: a five-country analysis of the impact of four different Haemophilus influenzae type b conjugates and vaccination strategies in Scandinavia. Journal of infectious diseases, 179(1), 223-229.
Peltola, H. (2000). Worldwide Haemophilus influenzae Type b Disease at the Beginning of the 21st Century: Global Analysis of the Disease Burden 25 Years after the Use of the Polysaccharide Vaccine and a Decade after the Advent of Conjugates. Clinical Microbiology Reviews, 13(2), 302–317.
Peter, G., & Myers, M. G. (2002). Intussusception, rotavirus, and oral vaccines: summary of a workshop. Pediatrics, 110(6), e67-e67.
Pițigoi Daniela, Crăciun Maria Dorina (2013). Poliomielita și vaccinurile polio în România. Conferința Națională de Microbiologie și Epidemiologie, București, 14-16 Noiembrie. [Prezentare]
Platt, L. R., Estívariz, C. F., & Sutter, R. W. (2014). Vaccine-associated paralytic poliomyelitis: a review of the epidemiology and estimation of the global burden. Journal of Infectious Diseases, 210(suppl 1), S380-S389.
Plotkin, S. A., Liese, J., Madhi, S. A., & Ortiz, E. (2011). A DTaP-IPV//PRP~ T vaccine (Pentaxim™): a review of 16 years’ clinical experience. Expert Review of Vaccines (Impact Factor: 4.22). 10(7):981-1005. DOI: 10.1586/erv.11.72
Poehling, K. A., Talbot, T. R., Griffin, M. R., Craig, A. S., Whitney, C. G., Zell, E., … & Schaffner, W. (2006). Invasive pneumococcal disease among infants before and after introduction of pneumococcal conjugate vaccine. Jama, 295(14), 1668-1674.
Posadzki P, Alotaibi A, Ernst E. Adverse effects of homeopathy: a systematic review of published case reports and case series. Int J Clin Pract 2012; 66: 1178–88.
Pruna, D., Balestri, P., Zamponi, N., Grosso, S., Gobbi, G., Romeo, A., Franzoni, E., Osti, M., Capovilla, G., Longhi, R. and Verrotti, A. (2013), Epilepsy and vaccinations: Italian guidelines. Epilepsia, 54: 13–22. doi: 10.1111/epi.12306
Ramakrishnan, M., Ulland, A. J., Steinhardt, L. C., Moïsi, J. C., Were, F., & Levine, O. S. (2009). Sequelae due to bacterial meningitis among African children: a systematic literature review. BMC Medicine, 7, 47. doi:10.1186/1741-7015-7-47
Ray, P., Black, S., Shinefield, H., Dillon, A., Carpenter, D., Lewis, E., … & Vaccine Safety Datalink Team. (2011). Risk of rheumatoid arthritis following vaccination with tetanus, influenza and hepatitis B vaccines among persons 15–59 years of age. Vaccine, 29(38), 6592-6597. (Abstract)
Richardson, V., Hernandez-Pichardo, J., Quintanar-Solares, M., Esparza-Aguilar, M., Johnson, B., Gomez-Altamirano, C. M., … & Patel, M. (2010). Effect of rotavirus vaccination on death from childhood diarrhea in Mexico. New England Journal of Medicine, 362(4), 299-305.
Ritz, N., Hanekom, W. A., Robins-Browne, R., Britton, W. J. and Curtis, N. (2008), Influence of BCG vaccine strain on the immune response and protection against tuberculosis. FEMS Microbiology Reviews, 32: 821–841. doi: 10.1111/j.1574-6976.2008.00118.x
Robertson, S., Drucker, J., Fabre-Teste, B., N’Diaye, M., Traverso, H., Rovira, E., … & Diouf, F. (1988). Clinical efficacy of a new, enhanced-potency, inactivated poliovirus vaccine. The Lancet, 331(8591), 897-899. (Abstract)
Rodrigues, L. C., Diwan, V. K., & Wheeler, J. G. (1993). Protective effect of BCG against tuberculous meningitis and miliary tuberculosis: a meta-analysis. International Journal of Epidemiology, 22(6), 1154-1158.
ROMANUS, V., JONSELL, R., & BERGQUIST, S. O. (1987). Pertussis in Sweden after the cessation of general immunization in 1979. The Pediatric infectious disease journal, 6(4), 364-371. (Abstract)
Roy, A., et al. (2014) “Effect of BCG vaccination against Mycobacterium tuberculosis infection in children: systematic review and meta-analysis.” bmj 349: g4643.
Rubin, S., Eckhaus, M., Rennick, L. J., Bamford, C. G. and Duprex, W. P. (2015), Molecular biology, pathogenesis and pathology of mumps virus. J. Pathol., 235: 242–252. doi: 10.1002/path.4445
Ruiz-Aragón, J., Peláez, S. M., Molina-Linde, J. M., & Grande-Tejada, A. M. (2013). Safety and immunogenicity of 13-valent pneumococcal conjugate vaccine in infants: A meta-analysis. Vaccine, 31(46), 5349-5358.
Ruiz-Palacios, G. M., Pérez-Schael, I., Velázquez, F. R., Abate, H., Breuer, T., Clemens, S. C., … & O’Ryan, M. (2006). Safety and efficacy of an attenuated vaccine against severe rotavirus gastroenteritis. New England Journal of Medicine, 354(1), 11-22.
Samad, L., Cortina-Borja, M., Bashir, H. E., Sutcliffe, A. G., Marven, S., Cameron, J. C., … Taylor, B. (2013). Intussusception incidence among infants in the UK and Republic of Ireland: A pre-rotavirus vaccine prospective surveillance study. Vaccine, 31(38), 4098–4102. doi:10.1016/j.vaccine.2013.06.084
Sangaré, L., Manhart, L., Zehrung, D., & Wang, C. C. (2009). Intradermal hepatitis B vaccination: a systematic review and meta-analysis. Vaccine, 27(12), 1777-1786. (Abstract)
Seddon, J. A., & Shingadia, D. (2014). Epidemiology and disease burden of tuberculosis in children: a global perspective. Infection and Drug Resistance, 7, 153–165. doi:10.2147/IDR.S45090
Schmitt, H. J., Faber, J., Lorenz, I., Schmöle-Thoma, B., & Ahlers, N. (2003). The safety, reactogenicity and immunogenicity of a 7-valent pneumococcal conjugate vaccine (7VPnC) concurrently administered with a combination DTaP-IPV-Hib vaccine. Vaccine, 21(25), 3653-3662. (Abstract)
Schneider-Schaulies, J., ter Meulen, V., & Schneider-Schaulies, S. (2003). Measles infection of the central nervous system. Journal of neurovirology, 9(2), 247-252.
Shahmahmoodi, S., Mamishi, S., Aghamohammadi, A., Aghazadeh, N., Tabatabaie, H., Gooya, M. M., … & Parvaneh, N. (2010). Vaccine-associated paralytic poliomyelitis in immunodeficient children, Iran, 1995–2008. Emerging infectious diseases, 16(7), 1133.
Shepard, C. W., Simard, E. P., Finelli, L., Fiore, A. E., & Bell, B. P. (2006). Hepatitis B virus infection: epidemiology and vaccination. Epidemiologic reviews, 28(1), 112-125.
Shui, I. M., Baggs, J., Patel, M., Parashar, U. D., Rett, M., Belongia, E. A., … & Weintraub, E. (2012). Risk of intussusception following administration of a pentavalent rotavirus vaccine in US infants. Jama, 307(6), 598-604.
Simons, F. E. R. (2009). Anaphylaxis: recent advances in assessment and treatment. Journal of Allergy and Clinical Immunology, 124(4), 625-636.
Slotved H-C, Dalby T, Hoffmann S (2014) Invasive Pneumococcal Isolates from Danish Infants (0-90 Days) during the Years 1943 to 2013. PLoS ONE 9(8): e106180. doi:10.1371/journal.pone.0106180
Soares-Weiser, Karla (2012). Rotavirus Vaccines Schedules: A systematic review of safety and efficacy from randomized controlled trials and observational studies of childhood schedules using RV1 and RV5 vaccines. World Health Organization Rotavirus Report.
Soares-Weiser, K., MacLehose, H., Bergman, H., Ben‐Aharon, I., Nagpal, S., Goldberg, E., … & Cunliffe, N. (2012). Vaccines for preventing rotavirus diarrhoea: vaccines in use. The Cochrane Library.
Steiner, M., Ramakrishnan, G., Gartner, B., Van Der Meeren, O., Jacquet, J. M., & Schuster, V. (2010). Lasting immune memory against hepatitis B in children after primary immunization with 4 doses of DTPa-HBV-IPV/Hib in the first and 2nd year of life. BMC infectious diseases, 10(1), 9.
Strachan, R. E., Snelling, T. L., & Jaffé, A. (2013). Increased paediatric hospitalizations for empyema in Australia after introduction of the 7-valent pneumococcal conjugate vaccine. Bulletin of the World Health Organization, 91(3), 167–173. doi:10.2471/BLT.12.109231
Strayer, D. S., & Rubin, R. (2012). Rubin’s pathology: Clinicopathologic foundations of medicine (6th ed.). Philadelphia: Lippincott Williams & Wilkins.
Strebel, P. M., Sutter, R. W., Cochi, S. L., Biellik, R. J., Brink, E. W., Kew, O. M., … & Hinman, A. R. (1992). Epidemiology of poliomyelitis in the United States one decade after the last reported case of indigenous wild virus-associated disease. Clinical infectious diseases, 14(2), 568-579.
Sun, Y., Christensen, J., Hviid, A., Li, J., Vedsted, P., Olsen, J., & Vestergaard, M. (2012). Risk of febrile seizures and epilepsy after vaccination with diphtheria, tetanus, acellular pertussis, inactivated poliovirus, and Haemophilus influenzae type B. JAMA, 307(8), 823-831.
Sung JJ, Tsoi KK, Wong VW, Li KC, Chan HL (2008). Meta-analysis: treatment of hepatitis B infection reduces risk of hepatocellular carcinoma. Aliment Pharmacol Ther;28:1067-1077
Swingler, G. H., Michaels, D., & Hussey, G. G. (2007). Conjugate vaccines for preventing Haemophilus influenzae type B infections. The Cochrane Library. (Abstract)
Takeuchi, M., Osamura, T., Yasunaga, H., Horiguchi, H., Hashimoto, H., & Matsuda, S. (2012). Intussusception among Japanese children: an epidemiologic study using an administrative database. BMC pediatrics, 12(1), 36.
Tate, J. E., Cortese, M. M., Payne, D. C., Curns, A. T., Yen, C., Esposito, D. H., … & Parashar, U. D. (2011). Uptake, impact, and effectiveness of rotavirus vaccination in the United States: review of the first 3 years of postlicensure data. The Pediatric infectious disease journal, 30(1), S56-S60.
Taylor, L. E., Swerdfeger, A. L., & Eslick, G. D. (2014). Vaccines are not associated with autism: An evidence-based meta-analysis of case-control and cohort studies. Vaccine, 32(29), 3623-3629.
Tazhibi, M., Hajivandi, A., Tafti, A. D., & Fallahzadeh, H. (2014). The efficacy of hepatitis B vaccine in Iranian population: A systematic review and meta-analysis. Journal of Education and Health Promotion, 3, 53. doi:10.4103/2277-9531.134741
Tejpratap, S. P., Tiwari, M. D. (2011). VPD Surveillance Manual, 5th Edition. Chapter 16: Tetanus.
Thierry-Carstensen, B., Dalby, T., Stevner, M. A., Robbins, J. B., Schneerson, R., & Trollfors, B. (2013). Experience with monocomponent acellular pertussis combination vaccines for infants, children, adolescents and adults—A review of safety, immunogenicity, efficacy and effectiveness studies and 15 years of field experience. Vaccine, 31(45), 5178-5191.
Trunz, B. B., Fine, P. E. M., & Dye, C. (2006). Effect of BCG vaccination on childhood tuberculous meningitis and miliary tuberculosis worldwide: a meta-analysis and assessment of cost-effectiveness. The Lancet, 367(9517), 1173-1180.
Van Damme, P., & Van Herck, K. (2007). A review of the long-term protection after hepatitis A and B vaccination. Travel medicine and infectious disease, 5(2), 79-84. (Abstract)
Velázquez, F. R., Colindres, R. E., Grajales, C., Hernández, M. T., Mercadillo, M. G., Torres, F. J., … & Verstraeten, T. (2012). Postmarketing surveillance of intussusception following mass introduction of the attenuated human rotavirus vaccine in Mexico. The Pediatric infectious disease journal, 31(7), 736-744.
Verma, R., Khanna, P., Chawla, S., Bairwa, M., Prinja, S., & Rajput, M. (2011). Hemophilus influenzae type b (Hib) vaccine: An effective control strategy in India. Human vaccines, 7(11), 1158-1160.
von Gottberg, A., de Gouveia, L., Tempia, S., Quan, V., Meiring, S., von Mollendorf, C., … & Cohen, C. (2014). Effects of vaccination on invasive pneumococcal disease in South Africa. New England Journal of Medicine, 371(20), 1889-1899.
Wagner, K. S., White, J. M., Lucenko, I., Mercer, D., Crowcroft, N. S., Neal, S., … on behalf of the Diphtheria Surveillance Network. (2012). Diphtheria in the Postepidemic Period, Europe, 2000–2009. Emerging Infectious Diseases, 18(2), 217–225. doi:10.3201/eid1802.110987
Wakefield, A. J., Murch, S. H., Anthony, A., Linnell, J., Casson, D. M., Malik, M., … & Walker-Smith, J. A. (1998). RETRACTED: Ileal-lymphoid-nodular hyperplasia, non-specific colitis, and pervasive developmental disorder in children. The Lancet, 351(9103), 637-641.
Wang, H., Hu, Y., Zhang, G., Zheng, J., Li, L., & An, Z. (2014). Meta-analysis of vaccine effectiveness of mumps-containing vaccine under different immunization srategies in China. Vaccine, 32(37), 4806-4812.
Watt, J. P., Wolfson, L. J., O’Brien, K. L., Henkle, E., Deloria-Knoll, M., McCall, N., … & Cherian, T. (2009). Burden of disease caused by Haemophilus influenzae type b in children younger than 5 years: global estimates. The Lancet, 374(9693), 903-911.
White, C. C., Koplan, J. P., & Orenstein, W. A. (1985). Benefits, risks and costs of immunization for measles, mumps and rubella. American Journal of Public Health, 75(7), 739–744.
WHO (2006). Diphtheria vaccine. Weekly epidemiological record 81 (3): 24–32.
WHO (2007). „Pneumococcal conjugate vaccine for childhood immunization–WHO position paper„. Wkly Epidemiol Rec (Geneva: World Health Organization) 82 (12): 93–104.
World Health Organization (WHO). Information sheet–Observed rate of vaccine reactions Bacille Calmette-Guérin (BCG) vaccine. 2012.
World Health Organisation (2014). Poliomyelitis Fact sheet N°114.
World Health Organization (2015a). Hepatitis B. Fact sheet N°204.
World Health Organization (2015b). Tuberculosis Fact sheet N°104.
Wichmann, O., & Ultsch, B. (2013). [Effectiveness, population-level effects, and heath economics of measles and rubella vaccination]. Bundesgesundheitsblatt, Gesundheitsforschung, Gesundheitsschutz, 56(9), 1260-1269. (Abstract)
Wilson, K., Mills, E., Ross, C., McGowan, J., & Jadad, A. (2003). Association of autistic spectrum disorder and the measles, mumps, and rubella vaccine: a systematic review of current epidemiological evidence. Archives of Pediatrics & Adolescent Medicine, 157(7), 628-634.
Yeh, S. H., Gurtman, A., Hurley, D. C., Block, S. L., Schwartz, R. H., Patterson, S., … & Scott, D. A. (2010). Immunogenicity and safety of 13-valent pneumococcal conjugate vaccine in infants and toddlers. Pediatrics, peds-2009.
Yen, C., Guardado, J. A. A., Alberto, P., Araujo, D. S. R., Mena, C., Cuellar, E., … & Patel, M. M. (2011). Decline in rotavirus hospitalizations and health care visits for childhood diarrhea following rotavirus vaccination in El Salvador. The Pediatric infectious disease journal, 30(1), S6-S10.
Yih, W. K., Lieu, T. A., Kulldorff, M., Martin, D., McMahill-Walraven, C. N., Platt, R., … & Nguyen, M. (2014). Intussusception risk after rotavirus vaccination in US infants. New England Journal of Medicine, 370(6), 503-512.
Zager, E. M., & McNerney, R. (2008). Multidrug-resistant tuberculosis. BMC Infectious Diseases, 8, 10. doi:10.1186/1471-2334-8-10
Zeller, M., Rahman, M., Heylen, E., De Coster, S., De Vos, S., Arijs, I., … & Matthijnssens, J. (2010). Rotavirus incidence and genotype distribution before and after national rotavirus vaccine introduction in Belgium. Vaccine, 28(47), 7507-7513.
Zhang, L., Prietsch, S. O., Axelsson, I., & Halperin, S. A. (2014). Acellular vaccines for preventing whooping cough in children. The Cochrane Library. (Abstract)
Zuckerman, J. N. (2006), Protective efficacy, immunotherapeutic potential, and safety of hepatitis B vaccines. J. Med. Virol., 78: 169–177. doi: 10.1002/jmv.20524 (Abstract)
Zwerling A, Behr MA, Verma A, Brewer TF, Menzies D, et al. (2011) The BCG World Atlas: A Database of Global BCG Vaccination Policies and Practices. PLoS Med 8(3): e1001012. doi:10.1371/journal.pmed.1001012
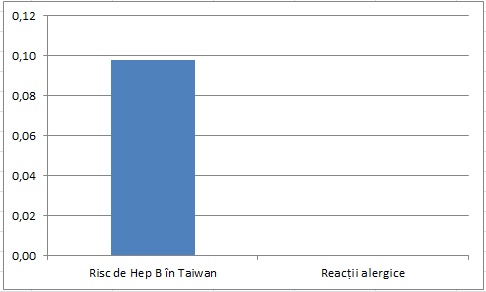
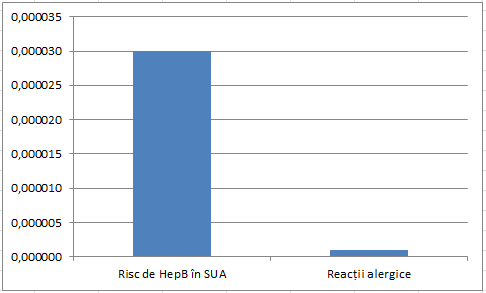
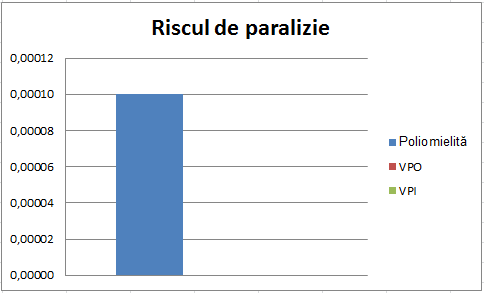
Excelent. Ar trebui sa renunț, esti mult mai bun, cand iei un subiect il epuizezi.
Mica clarificare: in prezent in RO pentru BCG se foloseste un vaccin bulgaresc care nu are tulpina identica cu cel de la SSI (cel ce a cauzat probleme in 2012). Poate te ajuta cand cauti pe la ANM.
Articolul meu nr 4 din seria despre vaccinuri a incercat sa faca acelasi lucru punand informatiile in tabel. Pentru mine e super clar ce e de ales.
Stilul tau e mult mai detaliat mai ales ca ai descris in detaliu fiecare boala, ceva ce eu n-as reusi fara copy/paste
Ma bucur ca ai atins rotavirus cu siguranta e o parte foarte importanta.
Mersi și de apreciere și de clarificare. Căutarea pe site-urile unor institute/instituții/organizații nu e unul din punctele mele forte. Întotdeauna mi se par organizate neclar.
Despre rotavirus am găsit cele mai multe informații și cred că se vede foarte bine care e raportul costuri-beneficii pentru vaccin.
Excelent articolul!Bine documentat – o vedere exhaustiva asupra sigurantei vaccinurilor cum n-am vazut altundeva.Ar fi bun de prezentat la o conferinta pe tema vaccinarilor.Am constatat ,insa, ca putini au rabdare sa parcurga articole lungi.Ar fi utila o sinteza, pentru cei care nu au rabdare…
Mulțumesc. Din punctul meu de vedere, oricine poate să preia cât vrea din articol, să-l scurteze, să-l corecteze, să-l rescrie, să-l prezinte etc.
O sinteză cred că ar arăta foarte asemănător cu meta-analiza lui Maglione: http://pediatrics.aappublications.org/content/early/2014/06/26/peds.2014-1079.full.pdf . Cel puțin în ce privește reacțiile vaccinurilor. Motivul pentru care am scris un articol lung este că cei care sunt împotriva vacicnurilor de multe ori cer studii care să arate ori că vaccinurile sunt eficiente, ori să arate câte efecte adverse produc. Și dacă am prezentat studii a devenit destul de lung articolul.
Poate ar fi fost bine să fac o sinteză la concluzii…
http://gsk.ro/Produsele-noastre/Vaccinuri/530/Engerix-Adult.aspx
Am un comentator, Gelu, care îmi arată că Guillain-Barré apare în prospect, secțiunea reacții adverse foarte rare (1 la 10 mii). Can’t beat that
Din pacate sindromul Guillain-Barré este citat in literatura medicala ca debut post vaccinarea antigripala, mai rar antipolio, asta pentru ca face parte din categoria afectiunilor autoimune si toate deficitele autoimune predispun la asa ceva. In cazul celorlalte vaccinari, inclusiv antiVHB, la noi este citat destul de rar, cred ca mai rar de 1/10000, poate chiar la 100 000, adica extrem de rar in rimul in care s-a vaccinat antiVHB in Romania in ultimii 20 ani.
În prospect scrie că următoarele reacții pot să apară cel mult la 1 din 10.000 doze de vaccin și este dată o listă de reacții, printre care e și sindromul Guillain-Barré. Asta nu înseamnă că toate apar la un caz din 10.000 (așa cum văd că presupune comentatorul tău, Gelu). Poate însemna oricât, 1 la 100.000, 1 la un milion, 1 la 10 milioane… . Motivul pentru care apare sindromul la reacții adverse pe prospect are probabil de-a face cu faptul că s-a suspectat o legătură în trecut. Între timp, au fost făcute studii mai bune și s-a observat că vaccinul hepatic B nu produce sindrom GB. Raportul făcut de Institute of Medicine în 2012 (Clayton et al.) a concluzionat că nu se poate face o legătură între cele două, iar un studiu mai nou pe care l-am citat ( http://cid.oxfordjournals.org/content/57/2/197.full ) a concluzionat că nu este nicio legătură. Dacă ne uităm la ce spune OMS http://www.who.int/vaccine_safety/initiative/tools/Hep_B_Vaccine_rates_information_sheet.pdf , în 1991 sindromul apărea la cei vaccinați la o rată de 5 cazuri la milion, iar în 2004 o analiză a mai multor studii de caz a sugerat o relație cauzală. Această analiză a fost făcută de un activist anti-vaccin Mark Geier ( https://en.wikipedia.org/wiki/Mark_Geier ), căruia i-a fost suspendată licența de practică pentru că promova tratamente dubioase pentru autism. Iar studiile sale sunt de nivelul studiului lui Wakefield.
Felicitari, din nou, pentru articol! Sper din suflet sa ii ajute pe cei care au dubii in privinta vaccinarii. O mica interventie am, daca nu e cu suparare. E posibil in loc de „tuberculoza militara” sa fie de fapt „tuberculoza miliara”? Multumesc!
Mulțumesc pentru corectură. E miliară, dar cum n-am auzit niciodată denumirea rostită și doar am citit-o, de fiecare dată am citit militară. Dacă mai sunt astfel de greșeli m-aș bucura să le aflu ca să le pot corecta.
Da, un articol foarte bine documentat, prinde foarte bine la publicul pro-vaccin, la cei ce nu au copii sau la cei ce au copii vaccinati fara nici o reactie imediata la vaccinuri ( desi reactiile vor veni in mod sigur in anii ce urmeaza), da, baga groaza in randurile noilor parinti care nu stiu in ce directie sa o apuce si ar face orice ca sa le mearga bine copiilor lor……. si mai ales un articol IUBIT DE INDUSTRIA FARMA:
Dar trimit cateva ganduri de la O MAMA CU COPIL IMBOLNAVIT IN URMA VACCINARII . De fapt o citez pe stimata doamna doctor Christa Todea Gross, un medic extraordinar, mai ales in lumea in care traim. Cine e curios de aceasta perspectiva sa intre pe urmatorul site:
http://www.pentruviatacluj.ro/vaccinurile-preventie-sau-boala-o-noua-patologie-pediatrica-dr-christa-todea-gross-editura-christiana-2012
Cine nu e curios – atunci sa mearga inainte , sa asculte cu sfintenie de nenea doctorul si tanti farmacista ca totul va fi `ca la carte ` exact cum se si doreste !!!! o societate de bolnavi cronici , dependenti pe viata de medicamente !!!
Prin continuarea programului naţional de vaccinare în masă a sugarilor şi copiilor din România, vom avea în curând un tineret bolnav, suferind de boli netra‑tabile, iar vinovaţi de această situaţie ne facem în primul rând noi, medicii.Statisticile arată că la ora actuală, în ţările dezvoltate (fără ca situaţia să ediferită de cea din ţara noastră, după constatările făcute), unul din doi copii suferă de alergie, tot al treilea copil suferă de dermatita/ eczema atopică şiunul din zece, de astm bronşic . Nici una dintre aceste boli nu are un tratament etiologic, ci doar unul simptomatic, adică ameliorează simptomele, dar nu vindecă (specific al bolilor cronice, inclusiv al celor alergice ). Este para‑doxul zilelor noastre: copii tot mai puţini şi tot mai bolnavi, cu toate că au crescut mijloacele de terapie şi mai ales condiţiile de
trai.
Se preconizează că, în decurs de 30 de ani, toţi copiii vor suferi de oboală alergică . Nu vor mai suferi de banalele boli eruptive, infecto‑con‑tagioase (rubeolă, rujeolă etc.), tratabile şi vindecabile în 3‑7 zile, şi careau menirea să le întărească sistemul imun, ci vor suferi o viaţă întreagăde boli cronice, ireversibile, de cele mai multe ori debilizante. Copiii cu poliomielită postvaccinală, encefalită postvaccinală, epilepsie şi alte boli cronice, debilizante, provocate de vaccinuri, trăiesc în mijlocul nostru, şi doar unii dintre ei au avantajul de a trăi într‑unul dintre puţinele Centre pentru persoanele cu dizabilităţi existente în ţara noastră. Statul nu are timp şi niciun interes să se ocupe de aceste victime nevinovate, dar are timp să facă propagandă unei“profilaxii” agresive şi foarte scumpe, cum este vaccinarea în masă a copiilor. De cele mai multe ori, părinţii sunt cei care fac şi acest sacrificiu, suportând costurile mari ale vaccinurilor. Companiile de medicamente şi vaccinuri stau liniştite şi fericite că şi‑au atins scopul, iar de 200 de ani încoace nimeni nu le poate sta împotrivă, într‑un climat mondial în care totul este o afacere. Până nu vor informaţi părinţii, studenţii de la Medicină şi toţi medicii, indiferent de specialitate, despre pericolul real al vaccinării în masă a sugarilor şi copiilor,
atât noi, cât şi copiii noştrii rămânem în continuare victimele “unui marketing perfect al industriei farmaceutice, al unor experimente corupte şi a ignoranţei autorităţilor care fac tot posibilul pentru a‑şi atinge scopul:acela de a deveni cândva cu toţii pacienţi” . Atât de “eficientă” a fost şi este Campania de vaccinare, generatoare de teamă, încât fiecare se lasă vaccinat, pentru ca apoi să se îmbolnăvească.
Un singur vaccin poate provoca una sau mai multe boli. Prin combinarea lor însă (aşa cum se întâmplă acum) se înmulţesc bolile, se intercondiţionează şi se agravează reciproc. Cu cât sunt administrate copiilor mai multe vaccinuri combinate (pentavaccin, hexavaccin), cu atât va fi mai dificilă studierea reacţiilor secundare şi a bolilor pe care le provoacă fiecare vaccin în parte.
Părinţii sunt singurii care mai pot lua o atitudine, spre binele lor şi al urmaşilor lor.
Vizitati si site-ul http://www.pentruviatacluj.ro/vaccinurile-preventie-sau-boala-o-noua-patologie-pediatrica-dr-christa-todea-gross-editura-christiana-2012
Bună Delia,
am putea să discutăm de fiecare detaliu din comentariul tău, dar propun altceva.
Înțeleg că n-o să-ți mai vaccinezi copilul din cauză că a suferit efecte adverse. Probabil că și eu în locul tău aș face la fel. M-ar speria îngrozitor. Însă nu aș merge atât de departe încât să recomand și altora să nu vaccineze. Iar motivul pentru care nu aș face asta cred că poate fi ilustrat mai bine cu un exemplu:
știm că este obligatoriu să purtăm centura de siguranță, iar această măsură a fost luată în urma unor constatări și studii care au arătat că, statistic vorbind, oamenii care poartă centură de siguranță sunt mai bine protejați. Știm de asemenea că pot apărea situații în care oameni care au purtat centura au murit, dar dacă n-ar fi purtat-o ar fi avut mai multe șanse să scape. Problema e că nu știm dinainte când e bine și când e rău să purtăm centura, așa că regula este să o purtăm întotdeauna pentru că astfel avem mai multe șanse în general. Dacă aș avea o experiență neplăcută cu centura de siguranță n-aș începe să recomand să nu mai fie folosită. M-aș teme mai mult când aș folosi-o eu și poate dacă n-ar fi obligatorie n-aș mai folosi-o. Dar n-aș recomanda altora să n-o folosească. Poate pare banal exemplul cu centura, dar ilustrează bine importanța statisticii.
Mai vreau să dau un exemplu. Am vorbit în articol de invaginarea intestinală la copii. Ea apare din cauze care nu sunt foarte bine cunoscute și apare cel mai des în perioada de 5-7 luni după naștere (o valoare de 70 cazuri la 100.000 copii). Asta se întâmplă și la copiii vaccinați și la cei nevaccinați. În doar 0,1% din cazuri (în Europa cel puțin) apare decesul. Din mai multe studii s-a aflat că riscul pe care îl aduce în plus vaccinul contra rotavirusului este între 1 și 5 la 100.000. În perioada asta de 5-7 luni se fac și vaccinuri. Să zicem că faci un vaccin, iar după câteva zile apare invaginarea intestinală. Instinctul îți spune că e din cauza vaccinului, dar în realitate probabil că nu este. Făcând o aproximare brută, din 75 cazuri, doar 5 sunt produse de vaccin, în timp ce 70 ar fi apărut oricum.
Presupunând că statisticile sunt corecte, ești de acord cu acest raționament sau e ceva greșit la el?
Știu că numerele sunt reci. Însă nu cunosc o metodă mai bună. Și până la urmă chiar și Christa Todea-Gross se folosește de numere și statistici. Sunt statisticile prezentate de ea credibile? Dar cele prezentate de mine?
Pe scurt, aș vrea să înțeleg care este de fapt motivul principal pentru care consideri că vaccinurile fac mai mult rău decât bine. Poate că motivul tău principal este unul îndreptățit, dar alte motive secundare pe care le-ai citit în alte părți nu sunt așa de îndreptățite. Poate putem afla mai multe despre acelea. Eu întotdeauna sper că putem găsi un punct comun cu care să fim de acord.
P.S.: dacă tot ai menționat companiile farmaceutice, vreau să te rog ceva: am în dreapta o imagine roșie pe care scrie AllTrials. Ai putea să intri acolo și să semnezi petiția? Ai ajuta astfel niște oameni să oblige companiile să facă publice toate datele din toate studiile clinice.
Delia, pe tine cu cat de plateste Todea Gross sa ii faci rost de clienti?
OK Alex, semnez petitia!!! Ai o putere mare de convingere caci te informezi bine pentru a sustine o parere. However, nu uita sa faci si tu vreo 2 ingerasi de copii si te asigur ca ai sa citesti literatura si din categoria anti !!! Si nu statisticile m-au impresionat sau ma impresioneaza. Meseria mea este de Steuerfachangestellte – am facut / fac statistici si nu ma conving sub nici o forma. Se ia o populatie – se face experimentul si se extrapoleaza. Sunt numere si calcule matematice – minunat dar hai sa nu ne jucam cu fiintele umane. Singurul sfat care imi permit sa il dau proaspetilor parinti este sa se informeze. Le recomand chiar cartea domnului doctor Martin Hirte : Impfen pro und contra – Das Handbuch für die individuelle Impfentscheidung„`Le recomand tuturor parintilor sa nu cedeze presiunilor din partea doctorilor, familiei, prietenilor, societatii ci sa ia o decizie bazata pe propriile investigatii. Nu e nevoie de studii medicale pentru acest lucru !!!! E nevoie de a accepta ideea dificila ca viata copilului tau este in primul rand in raspunderea parintilor si nu a societatii / doctorilor…..etc
Cristina scumpa, stai linistita o fac gratis pentru d-na Todea Gross !!! Pana la urma doamna Gross este si ea mama care a patit-o cu proprii copii in urma vaccinarii acestora…..deci vorbim de oameni cu experiente similare nu de doctori , nu de statistici, nu de cifre de afaceri, rate de rentabilitate, cont de profit si pierdere, comisioane, etc. Daca ma convingi si tu pe orice tema, iti fac rost de clienti si tie GRATIS. Chiar ma pasioneaza treaba asta caci am lucrat 8 ani in Romania pe post de Consilier credite… si chiar faceam rost de clienti 🙂 Numai bine !!! By the way…. ai citit cartea doamnei ca sa iti faci o impresie completa ??? sau macar a doctorului Martin Hirte , care scrie una din cele mai obiective carti legate de tema vaccinurilor……….. Numai bine !!!
Mă bucur. Am cam citit literatura anti (nu cărți întregi, dar părți din ele, inclusiv părți din cartea doamnei Todea-Gross). Desigur, când o să am copii o să mă informez de două ori pe-atât. E important ca lumea să fie informată corect. Cum am mai zis și înr-un articol anterior, problema mea e cu argumentele greșite, nu cu faptul că lumea încearcă să se informeze, și de aceea încerc să repar unele greșeli (ex. ideea că nu există studii care să compare eficiența unui vaccin comparativ cu un placebo).
Numai bine și ție!
Ba da este nevoie de studii medicale, chiar de a privi in profunzime. Recunosc sistemul imunitar este deosebit de complex. Un medic imunolog, dupa o viata de studii si de munca nu are cum sa-l cunoasca pe tot, doar o parte din el (relativ mica). Multi medici generalisti si pediatri eu cred ca nu il inteleg asa cum ar trebui.
Eu stiu ca medicii spun ceva, dar nu suficient de multe lucruri. De fapt iti zic prea putine.
Eu tentez un pronostic: cand ai sa devii tu insuti parinte, se aseaza balanta altfel. Sa fim sanatosi sa vedem atunci cum iesi din terenul teoretic!
As dori sa pun si eu o intrebare legata de vaccinul BCG. Daca e asa de bun si sigur cum se face ca in
Germania acest vaccin este INTERZIS? Medicii germani ii contesta eficacitatea iar efectele secundare pe
care le are sunt mult mai nocive. Repet, acest vaccin este INTERZIS si nu este optional.
Nu inteleg cum la noi lumea medicala este atat de oarba.
În Germania (și în restul țărilor dezvoltate) incidența tuberculozei este foarte mică. Vaccinul BCG din păcate nu oferă o protecție foarte mare contra infecției, dar oferă protecție împotriva manifestării bolii. Prin urmare, în locurile în care nu prea sunt cazuri de TBC, nu e justificată vaccinarea, în timp ce în locurile în care sunt multe cazuri (cum e și România), e justificată pentru că îi protejează pe cei infectați de forme grave. Acest vaccin este diferit față de celelalte și utilizarea lui este un pic contra-intuitivă. În timp ce altele sunt folosite pentru a ține sub control și a reduce răspândirea infecțiilor, BCG-ul e folosit pentru a reduce formele grave ale bolii.
Am dat o explicație asemănătoare într-un alt comentariu și, ca să nu fac copy-paste, puteți citi acolo: https://alexthyme.wordpress.com/2015/06/11/vaccinurile-partea-a-iv-a-fantoma-poliomielitei/#comment-665
Iar lumea medicală nu e chiar așa de oarbă. Există discuții despre cum ar fi mai bine, se pun în balanță riscurile și beneficiile, doar că nu există un consens de a renunța la BCG. Tot în acel comentariu am pus și un link către un articol din Viața Medicală în care chiar asta se discută. Probabil când o să mai scadă incidența tuberculozei la noi o să se renunțe la BCG.
Tot acest articol atata cum vaccinurile sunt eficiente din punct de vedere al costurilor reduse pentru firmele de asigurari medicale din USA si faptul ca toata lumea sa depinda de injectii/medicamente create artificial si pentru care statisticile nu se axeaza pe individ ci pe procente si probabilitati imprecise. Nimeni nu garanteaza nimic si nimeni nu poate spune ca un individ care s a defectat in urma vaccinarii s ar fi putut imbolnavi in acelasi mod sau mai rau cu unul dintre virusii pe care vaccinul il tinteste. Cred in selectia naturala si legatura cu natura se deterioreaza. Nu sunt de acord cu ele si imi pare rau ca am acceptat primele doua vaccinuri pentru sugarul nostru.
Ai putea să detaliezi un pic ce înțelegi prin statistici care se axează pe individ? Întreb pentru că zici că statisticile prezentate de mine nu se axează pe individ.
„Nimeni nu garantează nimic…” – da, pentru că nimeni nu poate garanta nimic decât în situația în care boala e eradicată (ex.: nimeni nu mai face variolă în prezent și nimeni nu se mai vaccinează contra ei; în curând sperăm să fie la fel și pentru polio). În rest e o cântărire a riscurilor și a beneficiilor. Să refuzi vaccinurile pe motiv că nu sunt perfecte (au reacții adverse grave de 1 la un milion) e ca și cum ai refuza să respecți regulile de circulație și să obți un carnet de șofer pe motiv că oricum poliția sau școala de șoferi nu pot garanta că n-o să faci un accident.
Eu nu vreau sa joc ruleta ruseasca cand imi da cineva pistolul in mana (injectia). Daca trebuie sa joc ruleta ruseasca, o sa o joc, cand se va imbolnavi. Macar va mai creste pana atunci si va deveni mai puternica.
Tu daca ai avea un copil cu sechele de la vaccin, ai mai accepta a 2a oara sa vaccinezi?
Am un caz in familie, cineva mai indeparatat.
Dacă aș avea un copil cu sechele de la vaccin, cel mai probabil nu ar mai fi indicat să-l vaccinez (adică nici medicii nu ar mai recomanda asta) și ar trebui să mă bazez pe imunitatea de grup. Dar înainte de a lua o decizie aș vrea să aflu dacă într-adevăr e de la vaccin. Dacă ar fi vorba despre autism, de exemplu, aș ști că nu-i de la vaccin pentru că atunci când sunt comparate două grupuri (vaccinați și nevaccinați), rata autismului e la fel în ambele grupuri. Dacă ar fi ceva despre care nu știu prea multe, aș investiga cât de mult aș putea și abia apoi aș lua o decizie în funcție de cât de mare e riscul.
Aud tot timpul ca rata de autism este la fel intre vaccinati si nevaccinati, dar nu reusesc sa gasesc astfel de studii si mai ales cine le-a platit si care au fost criteriile de selectie pt acestea. Sincer, nu am incredere in ele, nu e greu de masluit rezultatul unui studiu mai ales cand miza sunt miliarde de dolari. Se infiinteaza o societate non profit, care sa pastreze aparenta de impartialitate, sponsorizata pe la spate de companiile farmaceutice si rezultatul studiului este asigurat. Mai este o problema , legata de reticenta medicilor de a consemna efectele secundare ale unui vaccin. Cand ai un copil care si-a schimbat total conduita la o zi, doua dupa vaccin, si nu pentru cateva zile ci pentru luni sau ani de zile e greu de presupus ca e vorba de o coincidenta. Dar cand medicul refuza sa admita macar ca nu este exclusa o legatura intre vaccin si problemele de dupa, pentru ca a invatat el la scoala ca nu se poate asa ceva sau pentru ca se teme sa inoate impotriva curentului, statisticile care se bazeaza pe raportarile medicilor sunt irelevante.
O discutie deschisa pe marginea subiectului fara ironii,superioritati, insulte este absolut necesara, numai asa putem progresa in scopul nostru comun:oameni cat mai protejati impotriva a cator mai multe boli(rubeola, rujeola etc …dar si alergii, autism si alte minunatii).
Acestea fiind spuse , nu mi-as putea permite niciodata sa incerc sa conving pe altii sa nu-si vaccineze copiii, asa cum nu voi accepta vaccinarea obligatorie.
Daniela
Din punctul tău de vedere, care ar fi o sursă de finanțare acceptabilă pentru un studiu?
Spui că nu e greu de măsluit rezultatul unui studiu, mai ales când miza sunt miliarde de dolari. Cred că lucrurile nu sunt atât de directe și din fericire putem detecta cât de mult sunt influențate rezultatele cercetării și aș argumenta că ideea că pur și simplu pot cercetătorii să pună ce numere vor ei acolo nu e justificată. Influența are loc în alte moduri.
Cum știm cât de mare e influența? Putem de exemplu să comparăm rezultatele studiilor finanțate de industrie cu cele finanțate de guverne. Și au fost oameni care au făcut exact acest lucru. Dacă ne uităm la cercetarea finanțată de companiile de tutun (prin diverse grupuri-paravan) pentru a nega pericolul fumatului pasiv observăm că efectul finanțării e de 88 (adică dacă alegem la întâmplare un articol care spune că fumatul pasiv nu e periculos, sunt de 88 de ori mai multe șanse să fie finanțat de companiile de tutun).[1] Dacă ne uităm la studiile despre băuturile îndulcite (în special cola) și le comparăm pe cele finanțate de industrie cu cele independente, observăm un efect al finanțării de 17 (aceeași interpretare: dacă luăm la întâmplare un articol care spune că cola nu este rea pentru sănătate, sunt de 17 ori mai multe șanse ca articolul să fie finanțat de industrie decât să fie independent).[2] Dacă ne uităm la studiile despre medicamente și le comparăm pe cele finanțate de industrie cu cele finanțate de instituții ale statului sau organizații profesionale, observăm că efectul finanțării e în medie de 1,31 (pt. eficiență) și de 1,87 (pentru efecte adverse).[3] (această ultimă analiză a fost făcută de Colaborarea Cochrane, despre care nu se poate spune că e sub influența industriei, iar toate trei o au ca autoare pe Lisa Bero, care a publicat multă cercetare în care a expus metodele industriei). Există și estimări pentru anumite categorii de medicamente. De exemplu, pentru medicamentele psihiatrice efectul finanțării e mai mare decât media din medicină, mai exact e de 4,9 [4], iar pentru statine, efectul finanțării e 0 [5,6].În cazul tratamentelor pentru cancer, efectul finanțării e tot undeva între 1 și 2 și a mai scăzut cu timpul.[7]
Concluzia pe care o putem trage de aici e că există situații în care industria are mai mult spațiu de manevră și situații când are mai puțin, spre deloc. Totuși, metodele prin care cercetarea e manipulată nu sunt foarte simple și directe – doar industria tutunului a măsluit pe ici pe colo rezultate, dar de cele mai multe ori s-a folosit de alte tactici (știm asta din documente interne și din analize ale unor studii publicate; am scris un pic despre asta într-un alt articol[12]). Acele tactici sunt prea complicate ca să le detaliez aici, dar dacă vrei pot să-ți recomand niște cărți. Prima idee de reținut e că diverse industrii sunt reglementate diferit, astfel că industria tutunului are mult spațiu de manevră, industria alimentară mai puțin, iar industria farmaceutică și mai puțin.
Dar mergând pe ideea că industria poate să pună ce numere vrea în articole, să ne uităm care sunt cele mai vândute medicamente: https://www.statista.com/statistics/279916/top-10-therapeutic-classes-by-global-pharmaceutical-sales/ sau aici o listă mai detaliată: https://en.wikipedia.org/wiki/List_of_largest_selling_pharmaceutical_products
Ne-am aștepta să vedem cel mai mare efect al finanțării în cazul medicamentelor care se vând cel mai bine, dar nu se întâmplă asta. De exemplu, medicamentele psihiatrice sunt pe locul 8 la vânzări (în primul link), dar au una dintre cele mai mari influențe. Dacă companiile ar putea să modifice cum vor ele rezultatele, ar trebui ca efectul finanțării la tratamente pentru cancer să fie imens pentru că de acolo vine cel mai mare profit. Datele sugerează că influența industriei farmaceutice asupra rezultatelor este mică. Asta e a doua idee de reținut.
Când luăm aceste lucruri în considerare nu cred că putem justifica respingerea oricărui studiu pentru că a avut finanțare de la cineva cu un interes. Putem însă să fim precauți și în anumite cazuri să avem încredere scăzută în anumite rezultate (ex.: eu ignor orice studiu finanțat de industria tutunului și orice recenzie făcută de industria alimentară).
Nu știu care este efectul finanțării pentru vaccinuri, dar mă aștept să fie foarte mic (chiar zero dacă le excludem pe cele pentru gripă: Tamiflu are o poveste interesantă de date ascunse, http://www.bmj.com/tamiflu/). Zic asta pentru că datele din studiile clinice au fost făcute publice entru 90% dintre participanți [8], un număr foarte mare comparativ cu alte medicamente (iar când datele sunt ascunse, rezultatele sunt mai ușor de influențat, în special prin publicare selectivă, cum a fost în cazul antidepresivului reboxetină[9]). În plus, multe dintre studiile legate de vaccinuri sunt făcute de altcineva, nu de companiile farmaceutice.
De exemplu, un studiu foarte mare care a investigat legătura dintre autism și vaccinul ROR a fost făcut în Danemarca și a fost finanțat de instituții ale statului și a găsit rate asemănătoare de autism și la cei vaccinați și la cei nevaccinați [10]. Despre alergii, dermatită și imunitate scăzută am scris într-un alt articol [11] (și în acest caz există studii independente de industrie care arată că vaccinurile nu cresc riscul acestor probleme).
Bineînțeles, dacă cineva nu vrea nicicum să accepte că vaccinurile s-ar putea să nu producă autism, o să găsească probleme cu orice studiu. Și asta pentru că niciun studiu nu e perfect. Industria tutunului s-a folosit de scuza asta timp de decenii. Mai nou face la fel industria combustibililor pentru a nega încălzirea globală.[13] Dar cred că e periculos să ne așteptăm la perfecțiune și să nu ne lăsăm convinși de nicio dovadă doar pentru că *s-ar putea* să fie greșită. Și e și mai periculos să ne lăsăm convinși de studii mai slabe în timp ce ignorăm studii mai bune (din păcate am observat asta des la cei care promovează idei anti-vaccinuri).
P.S.: știu că m-am lungit, dar m-am folosit de ocazie pentru a scrie mai multe despre influența industriei, un subiect care pentru mine e fascinant.
1: https://jamanetwork.com/journals/jama/article-abstract/187551
2: http://journals.plos.org/plosone/article?id=10.1371/journal.pone.0162198
3: http://www.cochrane.org/MR000033/METHOD_industry-sponsorship-and-research-outcome
4: http://ajp.psychiatryonline.org/doi/pdf/10.1176/appi.ajp.162.10.1957
5: http://www.bmj.com/content/349/bmj.g5741
6: http://journals.plos.org/plosbiology/article?id=10.1371/journal.pbio.1001770
7: http://journals.plos.org/plosone/article?id=10.1371/journal.pone.0058711
8: http://www.bmj.com/content/348/bmj.g3058
9: https://opriviresceptica.wordpress.com/2016/03/09/meta-stiinta-ii-publicarea-selectiva/#_Toc443858826
10: http://www.nejm.org/doi/full/10.1056/NEJMoa021134#t=article
11: https://opriviresceptica.wordpress.com/2016/12/07/vaccinat-sau-nevaccinat/#_Toc468039313
12: https://opriviresceptica.wordpress.com/2016/10/07/fumatul-pasiv-si-legea-antifumat/#_Toc463471201
13: Oreskes, N., & Conway, E. M. (2011). Merchants of doubt: How a handful of scientists obscured the truth on issues from tobacco smoke to global warming. Bloomsbury Publishing USA.